KiyoyukiW. Miyasaka, BS,MS, MD; Yasuyuki Suzuki, MD, PhD; Emery N. Brown, MD, PhD; Yasuko Nagasaka, MD, PhD
JAMA Pediatr. 2025;179(7):704-712. doi:10.1001/jamapediatrics.2025.0517
Par le Dr Stéphanie Sigaut et Chrystelle Solla, pour le CS de la SFAR
Question évaluée :
La gestion de l’anesthésie guidée par électroencéphalographie (EEG) peut-elle réduire le délirium d’éveil post-anesthésique pédiatrique en minimisant l’exposition au sévoflurane ?
Le délirium d’éveil post-anesthésique en pédiatrie est une complication fréquente [1]. Il n’est pas seulement perturbant pour les parents et les soignants, mais il nécessite également du personnel infirmier supplémentaire pour éviter les blessures, les retrait de drain ou de cathéter par l’enfant [2]. Le principal facteur de risque, outre l’âge, est l’utilisation de l’anesthésie au sévoflurane [3]. Ses mécanismes physiopathologiques restent à élucider.
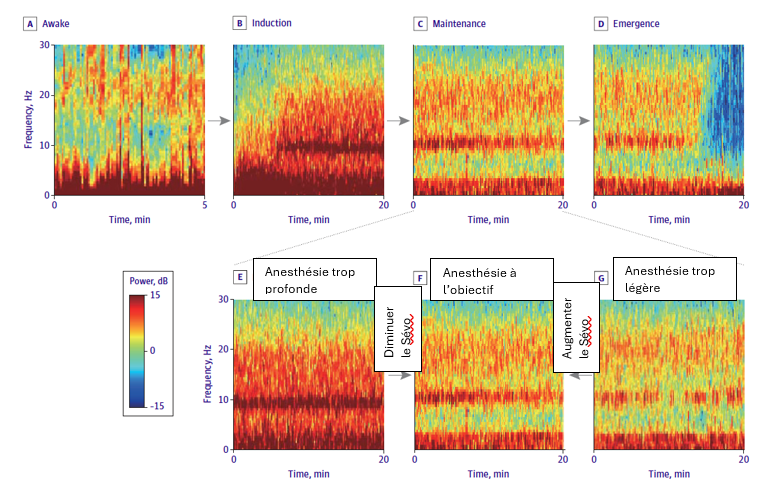
Le monitorage de l’EEG peropératoire, en permettant de titrer la dose de sévoflurane, pourrait donc permettre de diminuer l’incidence du délirium d’éveil pédiatrique. Si des études ont déjà évalué le BIS ou le PSI, celle analysée ici utilise une interprétation du tracé EEG avec spectrogramme.
Design :
Essai randomisé monocentrique réalisé au Japon, avec 2 bras parallèles : Anesthésie générale par sévoflurane standard vs guidée par l’EEG.
Critères d’inclusion/exclusions :
Ont été inclus des patients entre 1 et 6 ans, devant bénéficier d’une anesthésie générale d’au moins 30 minutes, pour des chirurgies des extrémités ou sous-ombilicales avec une douleur postopératoire prévue comme modérée (notamment grâce aux techniques d’ALR possibles).
Les enfants ayant des pathologies rendant difficilement interprétables l’EEG ou le score de délirium d’éveil étaient exclus.
Comparaison :
Anesthésie générale par sévoflurane standard vs guidée par l’EEG.
Le protocole d’anesthésie était le suivant :
- – Prémédication possible par diazépam
- Une électrode de monitorage EEG SedLine était mise en place chez tous les patients inclus avant l’induction, y compris dans le groupe contrôle afin de recueillir les données, mais l’écran du moniteur n’était pas visible de l’équipe anesthésique dans ce groupe.
- Pour le groupe contrôle :
- Induction au masque avec Sévoflurane 5% et NO 66%
- Arrêt du NO une fois l’accès veineux mis en place, réalisation de bolus de fentanyl 2 µg/kg et atropine 0,01 mg/kg, plus ou moins rocuronium 1 mg/kg.
- Après contrôle des voies aériennes, le sévoflurane est maintenu à 1 MAC et l’analgésie est réalisée par du rémifentanil 0,5 µg/kg/min
- ALR appropriée par ropivacaine.
- En fin de procédure, administration de fentanyl 1 à 2 µg/kg et paracétamol, arrêt du rémifentanil et du sévoflurane, décurarisation par sugammadex si besoin, et extubation dès reprise de la ventilation spontanée, puis transfert en SSPI.
- Pour le groupe EEG :
- Sévoflurane titré par l’EEG dès l’induction, en partant de 2%
- Le reste de la prise en charge est identique au groupe contrôle
En pratique, cette titration du sévoflurane par l’EEG était réalisée comme suit : augmentation ou diminution du sévoflurane afin d’obtenir un tracé alpha et delta lent continu et stable (spectrogramme F de la figure ci-dessous).
Il est à noter que cette prise en charge guidée par l’EEG était réalisée par un investigateur unique
Objectif principal :
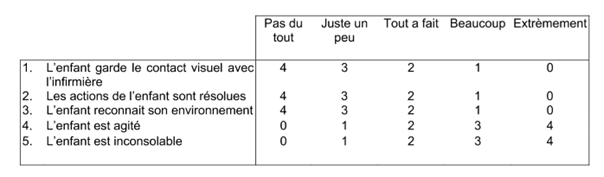
Comparer la proportion de patients ayant un PAED (pediatric anaesthesia emergence delirium) score > 10 dans les 30 minutes suivant leur arrivée en salle de réveil.
Il s’agit d’un score à 5 items, validé et largement utilisé dans la littérature sur le délirium d’éveil pédiatrique :
Il était évalué à 5, 10, 15 et 30 minutes après l’arrivée en SSPI.
Objectifs secondaires :
Score PAED maximal
Quantité de sévoflurane et autres drogues utilisées
Délais d’extubation et d’ouverture des yeux spontanée
Durée de séjour en SSPI
Donnée EEG (PSI, SEF, SR, artéfacts)
Analyses statistiques :
L’hypothèse utilisée pour le calcul d’effectif était une incidence de score PAED>10 de 38% dans le groupe contrôle avec une réduction de 50% dans le groupe EEG, aboutissant à un total de 180 patients à inclure.
Les différences de proportions ont été comparés par un Chi2, les différences de moyennes par un t test.
Les données EEG ont été évaluées statistiquement à l’aide d’une méthode de rééchantillonnage (bootstrap) adaptée aux données fréquentielles.
Résultats :
Au total 177 patients ont été inclus, dont 91 dans le groupe EEG. 71% étaient des garçons, en moyenne âgés de 3 ans.
Critère principal :
L’incidence d’un score PAED>10 en SSPI était de 21% (19/91) dans le groupe EEG, contre 35% (30/86) dans le groupe contrôle, avec donc une différence statistiquement significative de 14%; 96.65% CI,−0.0019% to 28%; 95%CI,0.92%to 27%; P = .04.
Critères secondaires :
La moyenne (écart-type) des scores maximaux de PAED était de 4,9 (5,9) dans le groupe guidé par EEG, contre 6,3 (5,8) dans le groupe contrôle (différence : 1,4 ; IC à 96,65 %, −0,5 à 3,3). La dose de sévoflurane était réduite dans le groupe guidé par EEG, avec une moyenne de 0,8 (0,5) MAC-heures contre 2,1 (1,1) MAC-heures dans le groupe témoin (différence : 1,4 MAC-heures ; IC à 96,65 %, 1,1 à 1,6 MAC-heures).
L’induction de l’anesthésie a été réalisée avec une concentration moyenne de 2,0 % de sévoflurane dans le groupe guidé par EEG, contre 5,0 % fixe pour le groupe témoin (différence : 3,0 % ; IC à 96,65 %, 2,9 % à 3,0 %).
L’entretien a été réalisé à une moyenne de 0,9 % (0,2 %), soit environ 0,36 MAC, dans le groupe guidé par EEG, contre 2,5 % (0,0 %), soit 1,0 MAC, dans le groupe témoin (différence : 1,6 % ; IC à 96,65 %, 1,6 % à 1,6 %).
L’extubation a eu lieu en moyenne 3,3 minutes plus tôt (IC à 96,65 %, 2,3 à 4,3 minutes), le réveil spontané (ouverture des yeux sans stimulation) 21,4 minutes plus tôt (IC à 96,65 %, 15,4 à 27,4 minutes), et la sortie de la salle de réveil (PACU) 16,5 minutes plus tôt (IC à 96,65 %, 10,8 à 22,3 minutes) dans le groupe guidé par EEG par rapport au groupe témoin.
L’analyse EEG a retrouvé des différences dans le spectrogramme de la minute précédant le réveil chez les patients qui vont présenter un délirium d’éveil et ceux qui n’en présenteront pas : Les patients avec délirium d’éveil présentaient une bande delta plus large, avec une activité légèrement accrue dans la gamme bêta durant la minute précédant l’ouverture spontanée des yeux, suggérant que la trajectoire de réveil des patients atteints de délirium d’éveil pédiatrique pourrait différer de celle des patients non atteints.
Commentaires :
Une gestion de l’anesthésie au sévoflurane guidée par l’EEG a dans cette étude permis de réduire significativement l’utilisation et l’exposition au sévoflurane chez des enfants âgés de 1 à 6 ans. Néanmoins, la réduction de l’incidence du délirium d’éveil, certes significative, n’a pas été aussi drastique et reste supérieure à 20%.
Le délirium d’éveil était dans cette étude plus fortement associé au pattern EEG précédant le réveil qu’aux doses cumulées de sévoflurane peropératoire. Chez les enfants inclus, un réveil via un état dominé par les ondes delta est une trajectoire fréquemment observée, et possiblement lié à une faiblesse de la connectivité frontale, qui n’est pas encore complètement développée à cet âge. Cela pourrait expliquer pourquoi ils sont plus sensibles au délirium lors du réveil d’une anesthésie induite par le sévoflurane.
Plusieurs limites viennent restreindre la validité externe de cet essai contrôlé randomisé :
- Le pattern d’EEG visé dans le groupe EEG est celui d’une anesthésie générale extrêmement légère, ne laissant aucune marge de sécurité vis-à-vis d’une mémorisation et de ses conséquences traumatisantes.
- Un seul médecin a réalisé toutes les anesthésies du groupe EEG, ce qui souligne la nécessité d’acquérir des compétences dans l’analyse des tracés et du spectrogramme, pratiques qui ne sont pas encore suffisamment répandus dans nos équipes pour généraliser cette méthode.
- Le protocole d’anesthésie utilisé par cette équipe japonaise est très différent des pratiques françaises, notamment avec une utilisation d’atropine et de NO, mais aussi concernant les opioïdes utilisés : fentanyl, doses très élevées de rémifentanyl (0,5 µg/kg/min contre plutôt 0,2-0,25 µg/kg/min dans les pratiques françaises).
- Dans le groupe contrôle, il n’y a pas de baisse anticipée du sévoflurane lors de la fermeture, le patient est maintenu à 1 MAC jusqu’à la fin de celle-ci, ce qui augmente artificiellement les délais d’extubation et de réveil par rapport à la pratique courante.
Il apparaît donc difficile de justifier par cette publication l’utilisation de l’EEG peropératoire selon ces modalités dans notre pratique quotidienne. Néanmoins, malgré ses limites, cette étude illustre que, en pédiatrie comme chez l’adulte (et en particulier chez le patient âgé), le monitorage de l’EEG peropératoire doit aller plus loin qu’un chiffre de BIS, les données apportées notamment par le spectrogramme apportant des informations capitales.
1. Cole JW, Murray DJ,McAllister JD, Hirshberg GE. Emergence behaviour in children: defining the incidence of excitement and agitation following anaesthesia. Paediatr Anaesth. 2002;12(5): 442-447.
2. Voepel-Lewis T, Malviya S, Tait AR. A prospective cohort study of emergence agitation in the pediatric postanesthesia care unit. Anesth Analg. 2003;96(6):1625-1630.
3. Mason KP. Paediatric emergence delirium: a comprehensive review and interpretation of the literature. Br J Anaesth. 2017;118(3):335-343.