Mis en ligne le 5 Avril 2010
Questions Fréquentes

Jean-Michel Constantin
Service de Réanimation Adulte, Pôle Anesthésie-Réanimation,
Hôtel-Dieu, CHU Clermont-Ferrand.
Question 1 – Quel volume courant et quelle pression de plateau en 2010 ?
Question 2 – Quels niveaux de PEP pour quels patients ?
Question 3 – Hypercapnie, fréquence ventilatoire, auto-PEP : quels objectifs ?
Question 4 – Ventilation posturale : où en est-on ?
Question 5 – Manœuvres de recrutement alvéolaire : quand, comment, pour qui ?
Question 6 – La ventilation du SDRA, et demain ?
[hr_shadow]
Question 1 – Quel volume courant et quelle pression de plateau en 2010 ?
Les études animales et cliniques portant sur les effets physiologiques d’une réduction du volume courant ont montré une diminution de l’inflammation pulmonaire et systémique, associée à une réduction des défaillances d’organes non-pulmonaires [1]. Les essais randomisés et contrôlés de la fin des années 90 et du début des années 2000 ont été largement critiqués pour des problèmes éthiques et méthodologiques. Ils ont cependant permis de prouver que l’utilisation de hauts VT était responsable d’une surmortalité. Il n’a pas été mis en évidence de différence significative dans les essais ayant comparé des « volumes inférieurs » entre eux. Le consensus actuel se situe donc entre 6 et 8 mL/kg [2]. Le volume pulmonaire étant indépendant de la masse grasse, le VT doit être réglé en fonction du poids idéal théorique et non du poids réel. Cette condition est d’autant plus importante que les patients sont en surpoids. La formule de calcul du poids idéal théorique selon Lorentz [16] est :
Pour les Hommes : T-100-[(T-150)/4]
Pour les Femmes : T-100-[(T-150)/2.5]
Figure 1 : Volumes pulmonaires (CRF) mesurés au scanner chez 2 patientes de poids différents mais de même taille (Données personnelles).
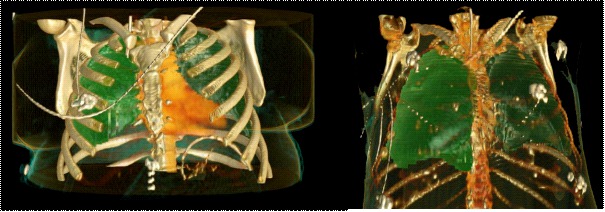
53 ans 1m62 132 kg 49 ans 1m61 47 kg
CRF = 3245 mL CRF = 3364 mL
Les lésions pulmonaires induites par la ventilation mécanique sont dues à l’utilisation de VT élevés mais aussi aux régimes de pressions alvéolaires importants. La pression de plateau (Pplat) est le reflet le plus accessible de la pression alvéolaire. Chez les sujets nonobèses, de nombreuses études ont permis d’aboutir à des recommandations strictes quant à la Pplat à ne pas dépasser. En effet, il ne faut en aucun cas dépasser une Pplat de 28 à 30 cmH2O [4]. Chez le patient obèse, la Pplat est moins bien corrélée à la pression trans-pulmonaire. Du fait de la diminution de la compliance pariétale, il est possible qu’il faille utiliser des pressions de plateau supérieures à 30 cmH2O chez certains patients pour générer une même pression trans-pulmonaire. A ce jour, le seul moyen de s’assurer de ces modifications est de mesurer la pression trans-pulmonaire à l’aide d’une sonde oesophagienne [16]. Cette procédure est lourde, invasive et difficile, ce qui explique son absence de diffusion. Il est donc plus raisonnable pour l’heure de recommander de limiter les pressions de plateau au même niveau chez l’obèse que chez le sujet sans surpoids. Toutefois, chez les grands obèses présentant un syndrome de détresse respiratoire aigue (SDRA) sévère, on pourra tolérer des pressions de plateau un peu plus élevées mais de façon transitoire et au mieux en essayant de mesurer la pression trans-pulmonaire. A l’opposé, chez certains patients, une Pplat de 30 cmH2O peut être trop élevée et délétère. Des outils simples et accessibles au lit du patient sont en cours de développement et devraient permettre, à court terme, de définir une Pplat « à la carte » en fonction de la mécanique ventilatoire de chaque patient [6].
Question 2 – Quels niveaux de PEP pour quels patients ?
Si le choix du volume courant est consensuel, celui de la PEP reste très débattu [2]. De nombreux essais randomisés et contrôlés se sont avérés négatifs. Un des facteurs pouvant expliquer ces résultats réside dans l’algorithme de réglage de la PEP. En effet, le rôle de la PEP est de lutter contre le collapsus alvéolaire et bronchiolaire, et non « d’améliorer » les échanges gazeux. Les algorithmes de réglage de la PEP basés sur la FiO2 sont donc probablement voués à l’échec. L’étude française EXPRESS [16] a proposé un algorithme basé sur la mécanique ventilatoire. Dans le bras interventionnel, la PEP était réglée de telle façon que la Pplat soit entre 28 et 30 cmH2O avec un VT de 6 à 8 mL/kg. Les résultats montraient une diminution de la durée de ventilation, des défaillances d’organes, de séjour… mais pas de mortalité.
Une des explications possible pour expliquer les résultats de ces études, est l’absence de prise en compte de la morphologie pulmonaire. Les travaux de l’équipe du Pr Rouby ont montré depuis plus de 10 ans que les effets de la PEP étaient différents selon que l’atteinte pulmonaire était lobaire ou diffuse [8]. On pourrait donc raisonnablement proposer, mais ceci n’a jamais été évalué sur une large cohorte de patients, un réglage de la PEP basé sur des données de la mécanique ventilatoire. Pour les patients présentant une atteinte pulmonaire de type diffuse, un réglage de type protocole EXPRESS . Pour les patients avec une atteinte lobaire, de faibles niveaux de PEP (< 10 cmH2O) doivent être recommandés. La morphologie pulmonaire peut être évaluée au scanner, à l’échographie pulmonaire, voire sur la radiographie pulmonaire, lorsque celle-ci est typique. Cette stratégie est résumée dans l’algorithme de réglage de la ventilation mécanique dans le SDRA en bas de page.
Figure 2 : Proposition d’algorithme de réglage du ventilateur dans le SDRA (d’après [9])
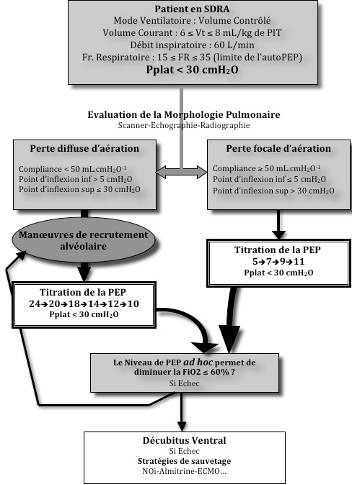
Question 3 – Hypercapnie, fréquence ventilatoire, auto-PEP : quels objectifs ?
La normalisation de la capnie « à tout prix » ne doit pas être un objectif [10]. La réduction du VT génère une diminution de la ventilation alvéolaire responsable d’une hypercapnie. Si celle-ci n’est pas « gênante » la plus part du temps, elle peut devenir problématique chez certains patients (Cérébrolésés,…) ou lorsqu’elle dépasse certains niveaux (>100 mmHg). La correction de l’acidose par administration de Bicarbonate de sodium n’ayant jamais prouvé son intérêt [11], il faut donc essayer de réduire la capnie. La première façon est d’augmenter la fréquence ventilatoire. Celle-ci peut être augmentée jusqu’à 30-35 c/min, à la limite de l’auto-PEP. Limiter l’hypercapnie se fera aussi en limitant l’espace mort instrumental (suppression du filtre et du raccord annelé au profit d’une humidificateur réchauffeur actif) [16]. L’hypercapnie est le corolaire de la ventilation protectrice, elle doit être tolérée, faute d’être respectée.
Question 4 – Ventilation posturale : où en est-on ?
Le décubitus ventral (DV) améliore les échanges gazeux, et donc l’oxygénation, de la plupart des patients en SDRA. Au demeurant, tous les essais randomisés et contrôlés comparant le DV à un groupe contrôle ont été négatifs [13]. Le DV ne doit donc pas être proposé en routine aux patients en SDRA. Même si améliorer l’oxygénation n’est pas l’objectif principal de la ventilation mécanique, l’hypoxie peut parfois devenir menaçante et le DV ne doit pas être abandonné. Choisir les patients pouvant en bénéficier est dès lors une gageure pour le clinicien. Sur des bases physiologiques on pourrait proposer le DV aux patients présentant une atteinte lobaire, mais ceci reste discuté. Lorsque l’on propose des séances de DV, celles-ci doivent être prolongées, probablement de l’ordre de 20 heures [16]. La prévention des complications du DV devra être méticuleuse (complications cutanéo-muqueuses, ablation accidentelles des cathéters, œdème facial…). Une procédure écrite, adaptée à chaque service, est vivement conseillée.
Question 5 – Manœuvres de recrutement alvéolaire : quand, comment, pour qui ?
La PEP s’oppose au dérecrutement alvéolaire mais ne génère pas directement de recrutement des zones collabées. La réponse physiologique à ces constatations repose sur les manœuvres de recrutement alvéolaire (MRA). Celles-ci peuvent être réalisées par une CPAP continue de 40s avec un niveau de pression de 40 à 50 cmH2O ou par un soupir étendu [15]. Elles nécessitent une sédation profonde, voire une curarisation, et ne doivent pas être proposées à tous les patients. En effet, seuls les patients présentant une atteinte diffuse sont répondeurs aux MRA [16]. Chez les patients lobaires, elles génèrent plus de sur-distension que de recrutement et doivent être proscrites. Chez les patients répondeurs la tolérance hémodynamique est bonne. Elles doivent être réalisées précocement. Le rythme de leur répétition n’a fait l’objet d’aucune étude à ce jour. Si les MRA représentent une réponse logique au SDRA, elles n’ont pas été évaluées dans des études randomisées et contrôlées ce qui ne permet pas de les recommander formellement, mais encore moins de les proscrire [17]. Le but des MRA ne doit pas être d’améliorer la PaO2, mais de diminuer les zones condensées afin de faciliter une ventilation protectrice.
Question 6 – La ventilation du SDRA, et demain ?
L’avenir, en terme de ventilation du SDRA, se fera vers la prévention. Les données récentes portant sur des cohortes importantes commencent à montrer une diminution de l’incidence du SRDA [18]. La ventilation mécanique des patients qui ne sont pas encore en SDRA est probablement l’élément clé. L’utilisation systématique de VT entre 6 et 8 mL/kg, de PEP suffisamment élevée et la lutte contre le dérecrutement réduisent l’inflammation pulmonaire et les lésions alvéolaires [19]. Cette stratégie, initiée dés la mise sous ventilation mécanique, paraît capable d’éviter la survenue d’un SDRA, pathologie de toute évidence « iatrogène » !
Lorsque l’atteinte pulmonaire est constituée, les cliniciens ont besoin d’outils d’analyse de la mécanique ventilatoire, disponibles au lit du patient, afin de proposer un traitement « à la carte » pour chaque patient. Un grand nombre d’études physiologiques a été conduit avec succès, les développements industriels sont en cours, demain est presque là !
Références :
[1] Ranieri VM, Suter PM, Tortorella C, De Tullio R, Dayer JM, Brienza A, et al. Effect of mechanical ventilation on inflammatory mediators in patients with acute respiratory distress syndrome: a randomized controlled trial. Jama. 1999;282(1):54-61.
[2] Putensen C, Theuerkauf N, Zinserling J, Wrigge H, Pelosi P. Meta-analysis: ventilation strategies and outcomes of the acute respiratory distress syndrome and acute lung injury. Ann Intern Med. 2009 Oct 20;151(8):566-76.
[3] Bouillanne O, Morineau G, Dupont C, Coulombel I, Vincent JP, Nicolis I, et al. Geriatric Nutritional Risk Index: a new index for evaluating at-risk elderly medical patients. Am J Clin Nutr. 2005 Oct;82(4):777-83.
[4] Petrucci N, Iacovelli W. Lung protective ventilation strategy for the acute respiratory distress syndrome. Cochrane Database Syst Rev. 2007(3):CD003844.
[5] Talmor D, Sarge T, Malhotra A, O’Donnell CR, Ritz R, Lisbon A, et al. Mechanical ventilation guided by esophageal pressure in acute lung injury. N Engl J Med. 2008 Nov 13;359(20):2095-104.
[6] Grasso S, Stripoli T, De Michele M, Bruno F, Moschetta M, Angelelli G, et al. ARDSnet Ventilatory Protocol and Alveolar Hyperinflation: Role of Positive End-Expiratory Pressure. Am J Respir Crit Care Med. 2007 Jul 26.
[7] Mercat A, Richard JC, Vielle B, Jaber S, Osman D, Diehl JL, et al. Positive end-expiratory pressure setting in adults with acute lung injury and acute respiratory distress syndrome: a randomized controlled trial. JAMA. 2008 Feb 13;299(6):646-55.
[8] Rouby JJ, Constantin JM, Roberto De AGC, Zhang M, Lu Q. Mechanical ventilation in patients with acute respiratory distress syndrome. Anesthesiology. 2004 Jul;101(1):228-34.
[9] Jaber S, Constantin JM, Jung B, Chanques G. Conférence d’actualisation de la SFAR : Optimisation de la ventilation du SDRA. 2007.
[10] Hemmila MR, Napolitano LM. Severe respiratory failure: advanced treatment options. Crit Care Med. 2006 Sep;34(9 Suppl):S278-90.
[11] Gattinoni L, Taccone P, Carlesso E. Respiratory acidosis: is the correction with bicarbonate worth? Minerva Anestesiol. 2006 Jun;72(6):551-7.
[12] Richecoeur J, Lu Q, Vieira SR, Puybasset L, Kalfon P, Coriat P, et al. Expiratory washout versus optimization of mechanical ventilation during permissive hypercapnia in patients with severe acute respiratory distress syndrome. Am J Respir Crit Care Med. 1999 Jul;160(1):77-85.
[13] Fessler HE, Talmor DS. Should prone positioning be routinely used for lung protection during mechanical ventilation? Respir Care. Jan;55(1):88-99.
[14] Mancebo J, Fernandez R, Blanch L, Rialp G, Gordo F, Ferrer M, et al. A multicenter trial of prolonged prone ventilation in severe acute respiratory distress syndrome. Am J Respir Crit Care Med. 2006 Jun 1;173(11):1233-9.
[15] Constantin JM, Jaber S, Futier E, Cayot-Constantin S, Verny-Pic M, Jung B, et al. Respiratory effects of different recruitment maneuvers in acute respiratory distress syndrome. Critical care (London, England). 2008 Apr 16;12(2):R50.
[16] Constantin JM, Grasso S, Chanques G, Aufort S, Futier E, Sebbane M, et al. Lung morphology predicts response to recruitment maneuver in patients with acute respiratory distress syndrome. Crit Care Med. Apr;38(4):1108-17.
[17] Fan E, Wilcox ME, Brower RG, Stewart TE, Mehta S, Lapinsky SE, et al. Recruitment maneuvers for acute lung injury: a systematic review. Am J Respir Crit Care Med. 2008 Dec 1;178(11):1156-63.
[18] Frey TM. Incidence and prevention of ARDS: a measure of progress. Am J Respir Crit Care Med. 2009 Dec 1;180(11):1158.
[19] Determann RM, Royakkers A, Wolthuis EK, Vlaar AP, Choi G, Paulus F, et al. Ventilation with lower tidal volumes as compared with conventional tidal volumes for patients without acute lung injury: a preventive randomized controlled trial. Crit Care. 2010 Jan 7;14(1):R1.
Jean-Michel Constantin


