Mis en ligne le 1 Juin 2015
Questions Fréquentes

Marie-Pierre BONNET
Pôle ARTE
Hôpital Cochin
PARIS
marie-pierre.bonnet@cch.aphp.fr
Question 1 : Comment définir une hémorragie du post partum ?
Question 2 : Quelle surveillance doit être instaurée en cas d’HPP ?
Question 3 : Quelle stratégie transfusionnelle doit-elle être mise en place dans l’HPP ?
Question 4 : Quelle est la place de l’acide tranexamique dans le contexte de l’HPP ?
Question 5 : Quelle est la place de l’utilisation des concentrés de fibrinogène en cas d’HPP ?
Question 6 : Quelle stratégie globale de prise en charge ?
L’hémorragie du post partum (HPP) est définie classiquement par des pertes sanguines en provenance du tractus génital égales ou supérieures à 500 mL après un accouchement (1). Elle concerne 5 à 10% des accouchements. Cependant cette définition se heurte à la difficulté en pratique clinique de mesurer de manière fiable les pertes sanguines dans ce contexte. En effet, il est largement démontré que l’évaluation clinique des pertes sanguines, même par un praticien expérimenté, sous-estimait les pertes réelles. L’utilisation d’un sac collecteur améliore cette estimation mais peut être faussée par la présence de liquide amniotique, ou en cas de saignement non extériorisé. C’est pourquoi des définitions de l’HPP fondées sur des paramètres cliniques de mauvaise tolérance de saignement ou sur des paramètres biologiques (chute de la concentration d’hémoglobine) ont été proposées, mais elles possèdent également leurs propres limites : apparition trop tardive pour les signes cliniques, de même chute de l’hémoglobine décalée dans le temps du fait de l’hémoconcentration initiale. Ainsi, il n’existe pas de définition unique et satisfaisante de l’HPP, ce qui peut expliquer en partie les différentes incidences rapportées dans la littérature.
Question 2 : Quelle surveillance doit être instaurée en cas d’HPP ?
Dès le diagnostic posé, un monitorage clinique non invasif (électrocardioscope, pression artérielle au brassard, SpO2, diurèse) doit être installé pour surveiller l’apparition de signes de mauvaise tolérance hémodynamique. En cas d’aggravation, il s’agira de mettre en place un monitorage continu de la pression artérielle invasive.
Des bilans biologiques fréquents et répétés doivent être réalisés. La recherche répétée d’une anémie aigue par la mesure de l’hémoglobine capillaire est indispensable dans ce contexte. L’apparition et la sévérité d’une coagulopathie sont évaluées par des mesures répétées de la numération plaquettaire et de l’hémostase (TP, TCA, fibrinogène plasmatique). Il est maintenant clairement établi qu’un taux de fibrinogène plasmatique <2g/dL est un marqueur de gravité de l’HPP (2-3) et doit donc être recherché de manière régulière. Les techniques de thrombo-élastographie sont de plus en plus évoquées, mais, en l’absence de validation dans le contexte obstétrical, leur usage ne peut être recommandé en routine.
Question 3 : Quelle stratégie transfusionnelle doit-elle être mise en place dans l’HPP ?
Très peu de données sont disponibles dans la littérature pour guider la stratégie transfusionnelle dans l’HPP. Les recommandations d’experts se fondent majoritairement sur des résultats observés dans d’autres contextes, et en particulier en traumatologie. Il est toutefois largement recommandé de pouvoir transfuser sans délai une femme en concentrés globulaires O négatif en cas d’HPP sévère et brutale, et donc de disposer d’une réserve de produits sanguins labiles, notamment en l’absence de banque du sang sur place.
Chez le patient traumatisé, de nombreuses études de cohorte ont mis en évidence une réduction de la mortalité associée à l’administration de PFC et de CG dans un rapport 1 pour 1 dans un contexte de transfusion massive. Ces résultats font l’objet d’une controverse, un biais de survie ne pouvant être éliminé, mais devant l’abondance des preuves, les dernières recommandations de l’ANSM sur la transfusion de PFC et celles sur la prise en charge de la coagulopathie chez le traumatisé considèrent que l’application d’une telle stratégie est justifiée en cas de choc hémorragique et de transfusion massive (4-5). Dans le contexte obstétrical, aucune étude n’existe permettant de déduire des attitudes thérapeutiques. Par analogie avec la traumatologie, la stratégie de 1 PFC pour 1 CG pourrait être réservée uniquement en cas d’HPP avec transfusion massive.
Question 4 : Quelle est la place de l’acide tranexamique dans le contexte de l’HPP ?
L’efficacité de l’acide tranexamique à réduire les pertes sanguines est largement prouvée par des essais randomisés contrôlés de qualité dans le contexte de la chirurgie programmée comme l’orthopédie, la chirurgie vasculaire, hépatique ou encore urologique. De plus l’étude CRASH-2 montre que l’administration de 1g d’acide tranexamique suivie d’une administration de 1g sur 8h diminuait la mortalité des traumatisés (6). Par contre, les preuves de l’efficacité de l’acide tranexamique dans le contexte de l’HPP sont très faibles (7). Il n’existe qu’une seule étude randomisée contrôlée s’intéressant au traitement curatif de l’HPP par acide tranexamique (8). Celle-ci montrait que l’administration de fortes doses d’acide tranexamique pourrait diminuer les pertes sanguines au cours d’une HPP de plus de 800 mL. Les autres études concernent toutes l’administration prophylactique d’acide tranexamique, dont une méta-analyse retrouve une diminution significative des pertes sanguines (9-10). Du fait du faible cout de cette molécule et de l’absence d’effet secondaire sévère observé malgré son utilisation ancienne, il est urgent de réaliser un essai de qualité sur le traitement curatif de l’HPP par acide tranexamique. En ce sens les résultats de l’essai multicentrique WOMAN, seront indispensables pour décider de la place de cette molécule dans la prise en charge de l’HPP.
Question 5 : Quelle est la place de l’utilisation des concentrés de fibrinogène en cas d’HPP ?
Le concentré de fibrinogène apparait comme une thérapeutique prometteuse dans le traitement des HPP sévères. Cependant, son efficacité repose principalement sur 3 études randomisées contrôlées de faible taille, réalisées dans des contextes de chirurgie programmée (cystectomie radicale, pontage coronaire et cure d’anévrysme aortique), deux de ces études ne retrouvant pas de bénéfice en termes d’épargne transfusionnelle. Effectivement, dans le domaine de l’HPP, le taux de fibrinogène plasmatique est corrélé à la sévérité de l’HPP. Mais le lien direct entre correction d’une hypofibrinogénémie et amélioration du pronostic des HPP sévères n’a jamais été démontré par des essais randomisés contrôlés, ni par des études de cohorte. D’autre part, son utilisation pourrait être associée à une augmentation du risque thromboembolique, très peu exploré jusqu’à présent. Jusqu’à peu de temps, Il n’existait que des cas cliniques ou des séries de cas publiés sur l’utilisation du concentré de fibrinogène dans l’HPP. Récemment le premier essai randomisé contrôlé en double aveugle explorant l’efficacité du fibrinogène concentré dans l’HPP a été publié dans le BJA (11). Dans cet essai, les femmes présentant des pertes sanguines supérieures à 1000mL après césarienne ou 500mL après un accouchement voie basse étaient randomisées et recevaient soit 2g de fibrinogène concentré soit un placebo. Aucune différence n’a été observée entre les deux groupes concernant les besoins transfusionnels de ces patientes, que ce soit dans les 24 heures qui suivent l’HPP comme dans les 6 semaines après l’accouchement. Mais il faut relever que du fait du design de l’étude, les patientes les plus sévères n’étaient pas inclues, alors qu’elles représentent la population cible de ce traitement. De ce travail, on peut donc uniquement conclure qu’il n’y a pas de preuve en faveur d’un intérêt de l’administration de fibrinogène concentré à la phase précoce de l’HPP.
Les dernières recommandations européennes concernant la prise en charge des hémorragies massives péri-opératoires stipulent que l’utilisation de fibrinogène concentré peut être recommandée en cas d’hémorragie massive associée à un taux de fibrinogène <2g/L, mais avec un grade faible (1C) (12). Ainsi, comme pour l’acide tranexamique, des études randomisées contrôlées sur l’effet de l’administration de concentrés de fibrinogène sur les pertes sanguines en cours d’HPP sévères et des effets secondaires sont urgentes à réaliser.
Question 6 : quelle stratégie globale de prise en charge ?
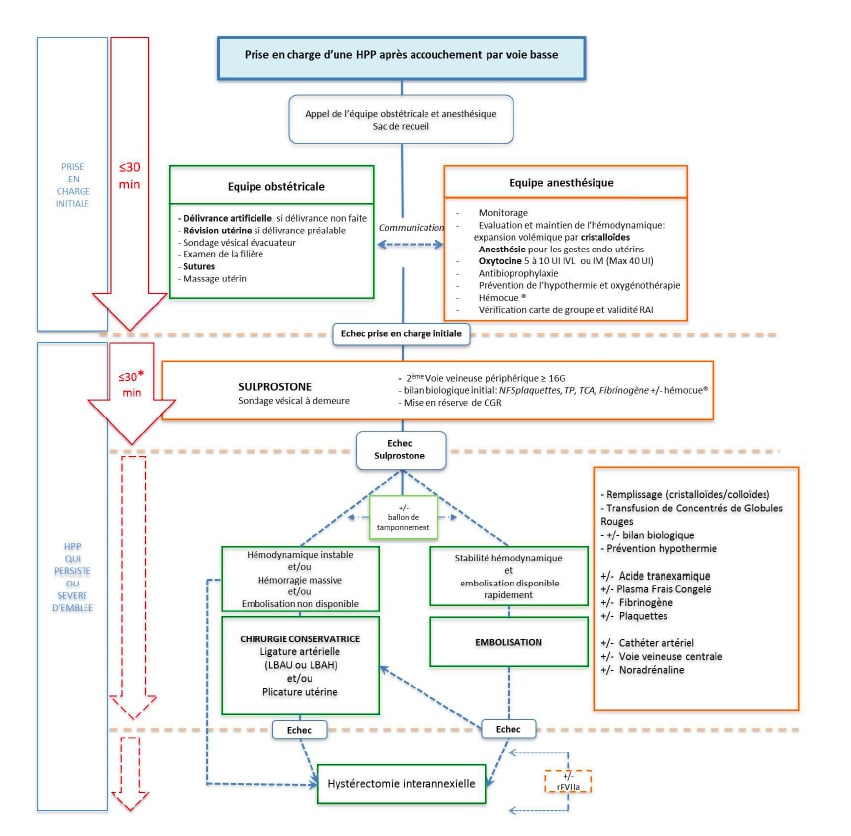
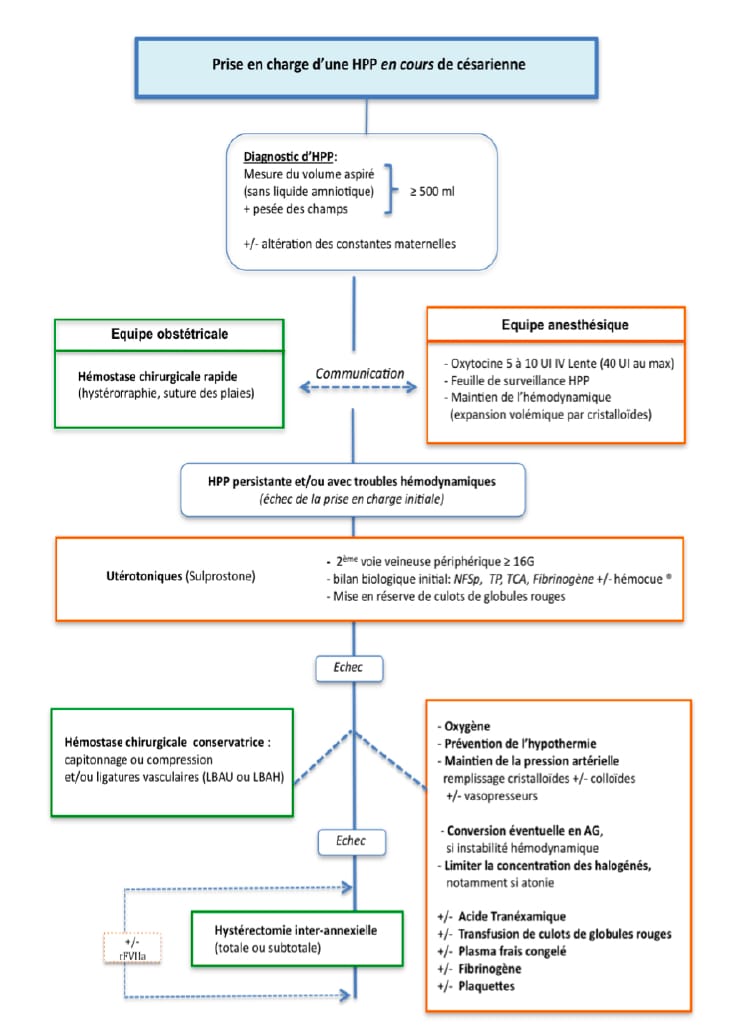
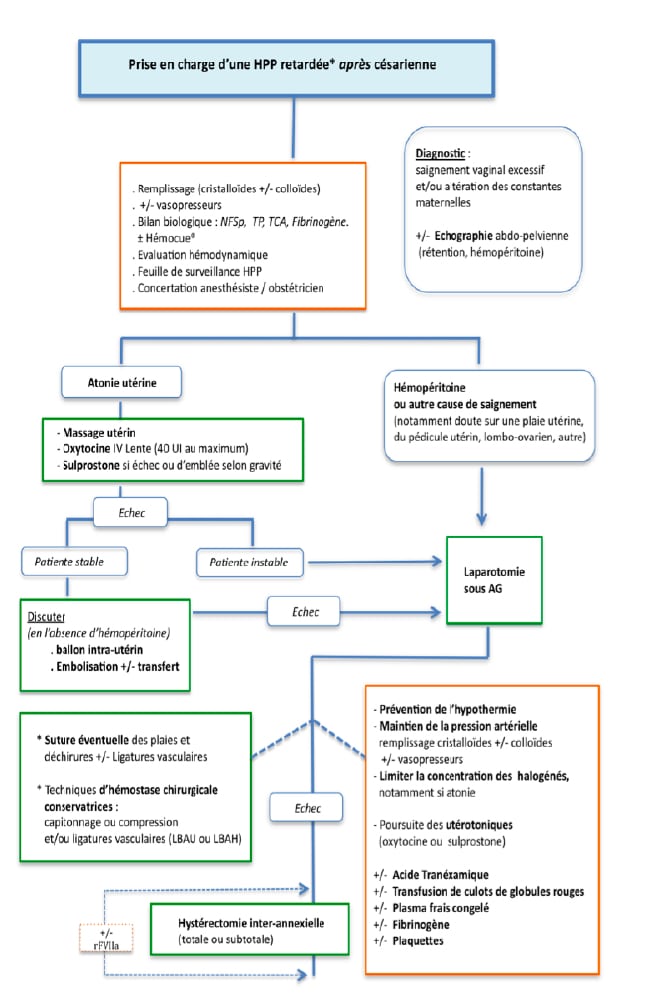
Les algorithmes de prise en charge de l’HPP en fonction de la voie d’accouchement ont été proposés dans les dernières recommandations pour la pratique clinique sur les hémorragies du post-partum (texte court) élaborées par le Collège national des gynécologues et obstétriciens français et sont consultables à l’adresse suivante : www.cngof.asso.fr/data/RCP/CNGOF_2014_HPP.pdf
Références
1. World Health Organization (WHO) recommendations for the prevention and treatment of postpartum haemorrhage. Edited by WHO. Geneva, WHP, 2012
2. Charbit B, Mandelbrot L, Samain E, Baron G, Haddaoui B, Keita H, Sibony O, Mahieu-Caputo D, Hurtaud-Roux MF, Huisse MG, Denninger MH, de Prost D, Group PPHS: The decrease of fibrinogen is an early predictor of the severity of postpartum hemorrhage. J Thromb Haemost 2007; 5: 266-73
3. Cortet M, Deneux-Tharaux C, Dupont C, Colin C, Rudigoz RC, Bouvier-Colle MH, Huissoud C: Association between fibrinogen level and severity of postpartum haemorrhage: secondary analysis of a prospective trial. Br J Anaesth 2012; 108: 984-9
4. santé Andsdmedpd: Transfusion de plasma thérapeutique: produits, indications. Actualisation 2012. Edited by (HAS) HAdS, 2012
5. Spahn DR, Bouillon B, Cerny V, Coats TJ, Duranteau J, Fernandez-Mondejar E, Filipescu D, Hunt BJ, Komadina R, Nardi G, Neugebauer E, Ozier Y, Riddez L, Schultz A, Vincent JL, Rossaint R: Management of bleeding and coagulopathy following major trauma: an updated European guideline. Crit Care 2013; 17: R76
6. Shakur H, Elbourne D, Gulmezoglu M, Alfirevic Z, Ronsmans C, Allen E, Roberts I: The WOMAN Trial (World Maternal Antifibrinolytic Trial): tranexamic acid for the treatment of postpartum haemorrhage: an international randomised, double blind placebo controlled trial. Trials 2010; 11: 40
7. Sentilhes L, Lasocki S, Ducloy-Bouthors AS, Deruelle P, Dreyfus M, Perrotin F, Goffinet F, Deneux-Tharaux C. Tranexamic acid for the prevention and treatment of postpartum haemorrhage. Br J Anaesth. 2015 Apr;114(4):576-87
8. Ducloy-Bouthors AS, Jude B, Duhamel A, Broisin F, Huissoud C, Keita-Meyer H, Mandelbrot L, Tillouche N, Fontaine S, Le Goueff F, Depret-Mosser S, Vallet B, Group ES, Susen S: High-dose tranexamic acid reduces blood loss in postpartum haemorrhage. Crit Care 2011; 15: R117
9. Ferrer P, Roberts I, Sydenham E, Blackhall K, Shakur H: Anti-fibrinolytic agents in post partum haemorrhage: a systematic review. BMC Pregnancy Childbirth 2009; 9: 29
10. Novikova N, Hofmeyr GJ: Tranexamic acid for preventing postpartum haemorrhage. Cochrane Database Syst Rev 2010: CD007872
11. Wikkelsø AJ, Edwards HM, Afshari A, Stensballe J, Langhoff-Roos J, Albrechtsen C, Ekelund K, Hanke G, Secher EL, Sharif HF, Pedersen LM, Troelstrup A, Lauenborg J, Mitchell AU, Fuhrmann L, Svare J, Madsen MG, Bødker B, Møller AM; FIB-PPH trial group. Pre-emptive treatment with fibrinogen concentrate for postpartum haemorrhage: randomized controlled trial. Br J Anaesth. 2015 Apr;114(4):623-33
12. Kozek-Langenecker SA, Afshari A, Albaladejo P, Santullano CA, De Robertis E, Filipescu DC, Fries D, Gorlinger K, Haas T, Imberger G, Jacob M, Lance M, Llau J, Mallett S, Meier J, Rahe-Meyer N, Samama CM, Smith A, Solomon C, Van der Linden P, Wikkelso AJ, Wouters P, Wyffels P: Management of severe perioperative bleeding: guidelines from the European Society of Anaesthesiology. Eur J Anaesthesiol 2013; 30: 270-382


