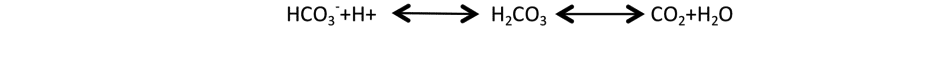Mis en ligne le 30 Septembre 2014
Questions Fréquentes

Réanimation médico chirurgicale
Hôpital St Roch CHU Nice
4 rue Pierre Dévoluy 06000 NICE
E-mail: quintard.h@chu-nice.fr
Question 1. LE CONCEPT D’HENDERSON HASSELBACH EST-IL UTILISABLE EN REANIMATION?
Question 2. COMMENT ANALYSE-T-ON UN TROUBLE ACIDO BASIQUE PAR LE PRINCIPE DE STEWART AU LIT DU PATIENT ?
Question 3. L’ACIDOSE HYPERCHLOREMIQUE EST-ELLE UN PROBLEME EN REANIMATION?
[hr_shadow]
Question 1. LE CONCEPT D’HENDERSON HASSELBACH EST-IL UTILISABLE EN REANIMATION?
L’approche d’Henderson-Hasselbach classiquement utilisée dans l’interprétation des troubles acido-basiques dans les services de réanimation s’appuie sur le rôle quasi-exclusif du tampon bicarbonate plasmatique et de son lien avec le taux d’acides forts plasmatiques, selon la relation :
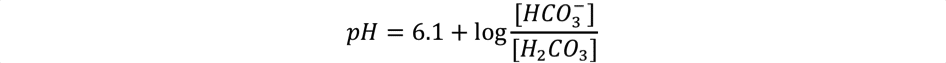
Celle-ci peut être simplifiée en y intégrant la pression partielle plasmatique en dioxyde de carbone :
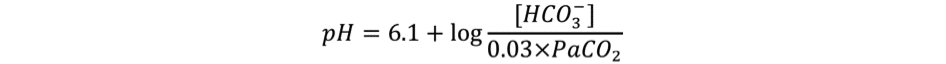 Cette approche attribue toute variation du pH plasmatique à une variation de la concentration en bicarbonates (trouble métabolique) et/ou de la PaCO2 (trouble respiratoire) [1, 2]. Bien que mathématiquement correcte, elle présente des limites qui sont :
Cette approche attribue toute variation du pH plasmatique à une variation de la concentration en bicarbonates (trouble métabolique) et/ou de la PaCO2 (trouble respiratoire) [1, 2]. Bien que mathématiquement correcte, elle présente des limites qui sont :
è La totale dépendance mathématique entre bicarbonates, acide carbonique (H2CO3) et PaCO2
- La présence de tampons non volatils, non bicarbonates ignorés dans cette équation tels que les protéines.
- Le rôle des acides faibles (albuminate principalement et phosphate) omis. Les variations de ces acides faibles sont loin d’être négligeables chez les patients de réanimation. En effet, différents travaux ont montré que l’hypoalbuminémie est un facteur quasi constant chez nos patients graves [3, 4].
Par conséquent, l’approche simpliste apportée par l’équation d’Hendersson-Hasselbach ne permet pas d’appréhender à elle seule l’ensemble des troubles acido-basiques que l’on peut rencontrer en réanimation.
Question 2. COMMENT ANALYSE-T-ON UN TROUBLE ACIDO BASIQUE PAR LE PRINCIPE DE STEWART AU LIT DU PATIENT ?
Dans les années 1970, Stewart apporte un nouveau concept reposant sur le degré de dissociation de l’eau plasmatique. L’acidité d’une solution est liée à sa capacité à dissocier l’eau plasmatique (par production de protons ou par liaison aux ions OH-) et inversement pour une base.
Ainsi le degré de dissociation du plasma doit obéir aux 3 principes physico-chimiques fondamentaux suivants:
- le principe d’électroneutralité (∑cations=∑anions)
- la loi de conservation de la masse (
 pour un acide faible)
pour un acide faible) - l’équilibre de dissociation électrochimique (dépendant de la constante de dissociation Ka).
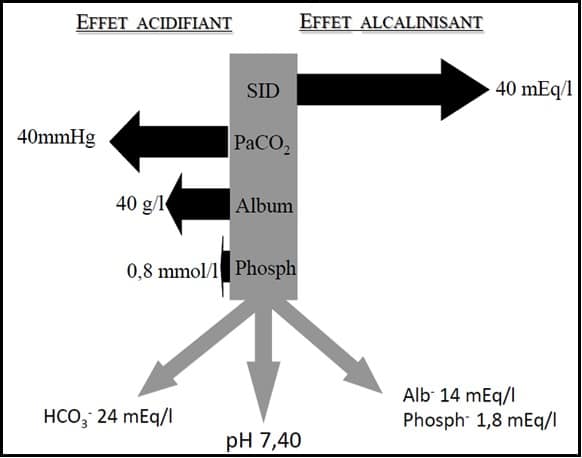
Dans cette approche, le pH plasmatique est donc déterminé par 3 variables indépendantes que sont:
Le SID est la différence entre cations forts (Na+ principalement) et anions forts plasmatiques (Cl- principalement). Il exerce un pouvoir alcalinisant sur le plasma. Il peut être appréhendé de 2 façons (N=40±2mEq/L):
Le SID apparent (SIDa) = Na+ + K+ + Mg ++ + Ca++ – (Cl– + lactate + anions forts indosés)
Le SID effectif (SIDe) = HCO3– + albuminate + phosphate
Normalement, du fait de la faible quantité d’anions indosés, SIDa≈SIDe= 40 mEq/L. Il est possible de quantifier au lit du patient les anions forts indosés par le calcul du Srong Ion Gap selon la formule (N=2±2mEq/L) :
SIG = SID apparent – SID effectif
SIG = [(Na+ + K+ + Ca++ + Mg++) – (Cl–+lactate)] – [HCO3– + albuminate + phosphate]
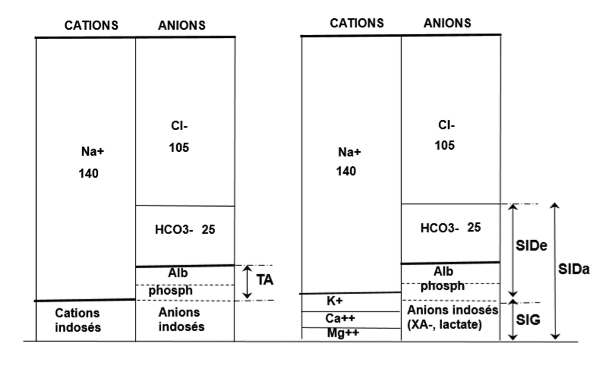
C’est l’équilibre de ces différentes « forces » qui définit le pH et induit en conséquence les modifications de bicarbonates plasmatiques, comme représenté sur ce schéma :
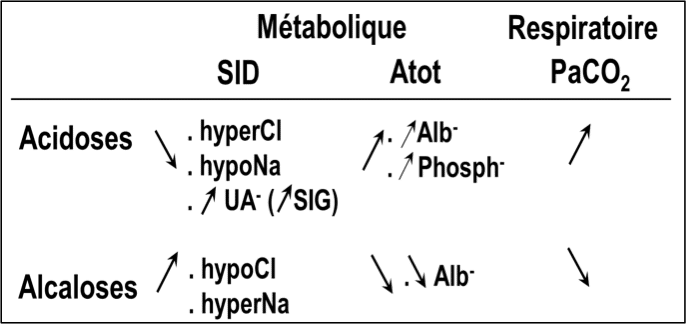
Ainsi une acidose peut être secondaire à une diminution du SID (baisse cations, augmentation anions), à une augmentation de la PaCO2, ou à une augmentation des acides faibles. A l’opposé, une alcalose est définie par une augmentation du SID (augmentation cations, baisse anions), une diminution PaCO2, ou une baisse des acides faibles (hypoalbuminémie, hypophosphorémie).
Par conséquent, malgré une application clinique semblant moins facile, le concept de Stewart permet une interprétation plus juste et précise, justifiant son utilisation systématique dans l’approche des troubles acido-basiques complexes en réanimation [5-7].
Question 3. L’ACIDOSE HYPERCHLOREMIQUE EST-ELLE UN PROBLEME EN REANIMATION?
L’acidose métabolique hyperchlorémique est fréquemment constatée chez les patients de réanimation et est souvent liée à l’administration de solutés cristalloïdes ou colloïdes riches en chlore, dit non balancés (SID<24mEq/L d’après le concept de Stewart) [8, 9]. La perfusion de NaCl isotonique reste la première cause d’acidose métabolique hyperchlorémique en réanimation [10]. La sévérité de l’acidose induite est corrélée à la richesse en chlore du soluté, son volume et sa rapidité d’administration, ainsi qu’à l’intégrité de la fonction rénale. Les effets délétères qui en découlent ont été démontrés dans différents travaux expérimentaux sur des modèles animaux : altération de la fonction rénale, troubles hématologiques, effets pro-inflammatoires, stress oxydant. En clinique, ces effets ne sont pas encore totalement démontrés et restent sujet à controverse. Malgré tout, chez le volontaire sain, la perfusion de sérum salé isotonique à 0,9 % en grande quantité est pourvoyeuse de retard de reprise de diurèse dans une étude l’ayant comparé au Ringer lactate [11]. D’autre part, des études récentes ont montré une augmentation de la morbi-mortalité chez des patients en sepsis ou dans le contexte en péri-opératoire qui présentaient une acidose hyperchlorémique [12, 13]. Cependant Toutes ces études sont rétrospectives et ne permettent pas de conclure de manière formelle sur l’imputabilité directe de l’acidose hyperchlorémique dans les effets délétères observés. Néanmoins, le principe de précaution nous amène aujourd’hui à privilégier dans notre pratique l’utilisation de solutés balancés chez les patients de réanimation dès lors que de grands volumes de perfusion sont nécessaires [14].
Question 4. Y A T IL UNE PLACE POUR L’ADMINISTRATION DE BICARBONATES DANS LE TRAITEMENT DE L’ACIDOSE METABOLIQUE EN REANIMATION?
Deux rappels s’imposent lorsqu’il s’agit d’aborder le traitement d’une acidose métabolique :
– Deux formes d’acidose sont à distinguer, les acidoses induites par un excès d’anions forts organiques et celles résultant d’anomalies des ions non organiques (chlore, sodium).
– La cause de l’acidose plus que sa profondeur influence les conséquences qu’elle induit.
Bien qu’elle induise des effets délétères (dépression myocardique, troubles du rythme cardiaque, vasodilatation, diminution de la réponse aux catécholamines, fatigabilité musculaire…), l’acidose est un phénomène adaptatif à respecter dans la mesure où il reste transitoire. Ses effets bénéfiques sont une épargne des réserves énergétiques en limitant la glycolyse, un déplacement de la courbe de dissociation de l’hémoglobine vers la droite améliorant l’oxygénation tissulaire, et une protection cellulaire contre l’apoptose [15, 16].
Ainsi le traitement dépend de la cause de l’acidose métabolique :
à Acidose métaboliques par excès d’anions forts organiques : Dans ce cas, le traitement est essentiellement étiologique. La métabolisation des anions aboutit à une normalisation spontanée du SID et du pH plasmatique ne justifiant pas l’administration de bicarbonate de sodium (BS). L’utilisation de bicarbonate dans cette indication peut même favoriser des alcaloses dites « rebond ». Ainsi par exemple, le traitement de l’acido-cétose diabétique repose essentiellement sur la réhydratation et l’insulinothérapie. Au cours, du choc septique, le recours au BS est plus discutée et les recommandations récentes de la Survinving Sepsis Campaign [17], ne préconisent une alcalinisation par BS qu’en cas d’acidose sévère avec un pH<7,15. Dans l’ACR, l’utilisation de BS est possible au-delà de 10 min. de réanimation. L’intoxication par tricycliques, l’hyperkaliémie menaçante restent également des indications potentielles.
à Acidoses non organiques (ex : hyperchlorémiques) : Bien que controversé, le BS est préconisé en cas de pH<7,20. Ce traitement n’étant que symptomatique, la meilleure démarche thérapeutique reste encore l’administration préventive de solutés balancés [18].
Dans tous les cas, lorsqu’elles sont utilisées, les solutions de BS doivent être administrées en perfusion lente, en évitant les bolus, sous leur forme hypo-osmolaire (en prévention de l’alcalose rebond) et en prenant soin de prévenir les effets indésirables (hypokaliémie et ajustement de la ventilation mécanique en réponse à la production de CO2).
Références
1. Spital, A. and S. Garella, Pathophysiology of metabolic acid-base disturbances in patients with critical illness. Critical Care Nephrology. Dordrecht, Kluwer Academic Publisher, 1998: p. 327-44.
2. Corey, H.E., Bench-to-bedside review: Fundamental principles of acid-base physiology. Crit Care, 2005. 9(2): p. 184-92.
3. Figge, J., et al., Anion gap and hypoalbuminemia. Crit Care Med, 1998. 26(11): p. 1807-10.
4. Kaysen, G.A., et al., Inflammation and reduced albumin synthesis associated with stable decline in serum albumin in hemodialysis patients. Kidney international, 2004. 65(4): p. 1408-1415.
5. Dubin, A., et al., Comparison of three different methods of evaluation of metabolic acid-base disorders*. Critical care medicine, 2007. 35(5): p. 1264-1270.
6. Quintard, H., S. Hubert, and C. Ichai. Qu’apporte le modèle de Stewart à l’interprétation des troubles de l’équilibre acide–base? in Annales francaises d’anesthesie et de reanimation. 2007. Elsevier.
7. Fencl, V., et al., Diagnosis of metabolic acid–base disturbances in critically ill patients. American journal of respiratory and critical care medicine, 2000. 162(6): p. 2246-2251.
8. Bellomo, R., et al., The effects of saline or albumin resuscitation on acid-base status and serum electrolytes*. Critical care medicine, 2006. 34(12): p. 2891-2897.
9. Noritomi, D.T., et al., Metabolic acidosis in patients with severe sepsis and septic shock: a longitudinal quantitative study. Critical care medicine, 2009. 37(10): p. 2733-2739.
10. Yunos, N.a.M., et al., The biochemical effects of restricting chloride-rich fluids in intensive care*. Critical care medicine, 2011. 39(11): p. 2419-2424.
11. Wilkes, N.J., et al., The effects of balanced versus saline-based hetastarch and crystalloid solutions on acid-base and electrolyte status and gastric mucosal perfusion in elderly surgical patients. Anesthesia & Analgesia, 2001. 93(4): p. 811-816.
12. Shaw, A.D., et al., Major complications, mortality, and resource utilization after open abdominal surgery: 0.9% saline compared to Plasma-Lyte. Annals of surgery, 2012. 255(5): p. 821-829.
13. McCluskey, S.A., et al., Hyperchloremia after noncardiac surgery is independently associated with increased morbidity and mortality: a propensity-matched cohort study. Anesthesia & Analgesia, 2013. 117(2): p. 412-421.
14. Bellomo, R., et al., Association between a chloride-liberal vs chloride-restrictive intravenous fluid administration strategy and kidney injury in critically ill adults. Jama, 2012. 308(15): p. 1566-1572.
15. Flacke, J.-P., et al., Acidic preconditioning protects endothelial cells against apoptosis through p38-and Akt-dependent Bcl-xL overexpression. Apoptosis, 2009. 14(1): p. 90-96.
16. Cohen, M.V., X.-M. Yang, and J.M. Downey, The pH hypothesis of postconditioning staccato reperfusion reintroduces oxygen and perpetuates myocardial acidosis. Circulation, 2007. 115(14): p. 1895-1903.
17. Dellinger, R.P., et al., Surviving Sepsis Campaign: international guidelines for management of severe sepsis and septic shock, 2012. Intensive care medicine, 2013. 39(2): p. 165-228.
18. Castaing, Y., et al., Correction de l’acidose métabolique en réanimation. Réanimation urgences, 1999. 8(6): p. 426-432.