Mis en ligne le 18 avril 2017
Article du mois
Variabilité de l’approche des anesthésistes dans la prise en charge pré opératoire des enfants asthmatiques
Journal of Clinical Anesthesia 2016; 35: 62.
Keren Armoni Domany MD, Guy Gut MD, Bat-El Yakir BSc , Yakov Sivan MD
Analyse réalisée par le Pr Souhayl DAHMANI et le Dr Delphine BEAUVAIS, pour le conseil scientifique de la SFAR.
Justification de l’étude :
Malgré la grande prévalence de l’asthme dans la population pédiatrique il n’existe pas de recommandation formalisée sur la prise en charge préopératoire des enfants asthmatiques alors même que cette pathologie est clairement identifiée comme un facteur de risque de complication respiratoire périopératoire (1).
Une étude Israélienne interrogeant des pneumologues pédiatres a mis en exergue les différences de prise en charge selon les praticiens. La présente étude nationale dans les 24 hôpitaux publics israéliens, évalue les pratiques des anesthésistes pédiatres pour la gestion périopératoire des enfants asthmatiques et compare les résultats aux précédents résultats des pneumologues pédiatres.
Méthodologie :
Le questionnaire a été envoyé par courrier, fax, email aux anesthésistes pédiatres ou délivré en main propre aux chefs de pôle qui le relayaient aux anesthésistes des départements de pédiatrie. Un rappel téléphonique ou par e-mail était réalisé en cas de non réponse dans les 10 jours.
Les résultats sont présentés en pourcentage de réponses positives ou regroupés en stratégie thérapeutique pour les cas cliniques puis comparés à ceux des pneumologues pédiatres.
Le questionnaire comprenait les éléments suivants :
- Détails démographiques et professionnels
- Questions sur les pratiques
- Facteurs influençant la prise en charge préopératoire en 11 questions à réponse booléenne
- 6 cas cliniques avec questions à choix multiples pour la prise en charge (tableau 1):
| Scénario | Age | Traitement de fond | Exacerbation | Stabilité |
| 1 | 9 | non | 1 / 1-2mois | partiellement stable |
| 2 | 8 | non | 1 / 6 mois | stable |
| 3 | 2 | CI faible dose | Aucune en 6 mois | stable |
| 4 | 2 | CI faible dose | 2 cures de corticoïdes per os en 6 mois | stable |
| 5 | 13 | CI dose moyenne + BMAL | 1 à 2 exacerbations par mois | instable |
| 6 | 7 | non | USI à 3 ans | Stable |
| CI = corticoïdes inhalés, BMAL = béta 2 mimétiques d’action longue, BMAC : béta 2 mimétiques d’action courte ; USI = unité de soins intensifs | ||||
Tableau 1 : Présentation des 6 scénarios
Résultats :
1) Données démographiques et professionnelles: 44 anesthésistes pédiatres sur 24 hôpitaux publics ont répondu à 94% des questions (83% d’hommes), 16% ont moins de 5 années d’expérience en anesthésie pédiatrique. Il n’y a pas de modification des résultats en fonction du nombre d’années de pratique.
2) Questions sur les pratiques :
- 100% des répondants indiquent que le traitement pré opératoire doit être évalué en fonction de la sévérité de l’asthme.
- 86% des répondants indiquent que corticothérapie intraveineuse (CS IV) avant la chirurgie peut s’envisager systématiquement pour 5%, en cas de risque d’insuffisance corticotrope suspectée ou avérée (50%), d’une exacerbation d’asthme dans les deux mois (20,5%), en continuité d’un traitement par corticothérapie inhalée à dose moyenne (27%) ou haute (50%).
- 25% souhaitaient une consultation avec un pneumologue et 35% une consultation avec le pédiatre traitant avant l’anesthésie.
3) Facteurs influençant la prise en charge préopératoire : les anesthésistes pédiatres estimaient qu’il y avait matière à augmenter le traitement de fond si :
- Exacerbation < 1mois : 73%
- Antécédent d’hospitalisation en ICU pour crise d’asthme : 68%
- Haute dose de corticoïdes inhalés: 78%
- 2 semaines de corticoïdes dans les 6 mois: 83%
- Toux nocturne > 2 nuits /semaine: 71%
- Type de chirurgie lourde et/ou touchant les voies aériennes: 68%
- Tabagisme passif ou actif: 40%
- Infirmité motrice d’origine cérébrale: 29%
- Exacerbation dans les 6 mois: 15%
- Histoire familiale d’atopie : 10%
Il n’y avait pas de différence significative entre les réponses des pneumologues et celles des anesthésistes concernant ces questions
4) Résultats et comparaison aux pneumologues pédiatres des réponses aux cas cliniques :
Une différence significative a été observée entre les pneumologues pédiatres (PP) et les anesthésistes pédiatres (AP) (p< 0,001) pour les scénarios 1 et 2.
| Scénario | 1 | 2 | 3 | 4 | 5 | 6 | ||||||
| Praticiens répondeurs | PP | AP | PP | AP | PP | AP | PP | AP | PP | AP | PP | AP |
| Aucun traitement | 0% | 5% | 2,5% | 32,5% | 6% | 16% | 2% | 7% | 0% | 13% | 3% | 25% |
| BMAC le matin de l’intervention | 11% | 20% | 21% | 42% | 36% | 39% | 11% | 9% | 9% | 35% | 12% | 30% |
| CI + BMAC 1-3 jours avant la chirurgie | 17% | 36% | 38% | 21% | 17% | 21% | 18% | 25% | 40% | 43% | 30% | 22% |
| CI + BMAC 4-7 jours avant la chirurgie | 7% | 10% | 11% | 5% | 7% | 5% | 4% | 16% | 19% | 8% | 17% | 11% |
| Corticoïdes per os 1-5 jours avant chirurgie | 30% | 10% | 9% | 0% | 11% | 5% | 11% | 9% | 9% | 0% | 12% | 3% |
| Corticoïdes per os 1-5 jours avant chirurgie + BMAC | 9% | 3% | 9% | 0% | 11% | 3% | 27% | 9% | 12% | 0% | 17% | 3% |
| Corticoïdes per os 1-5 jours avant chirurgie + BMAC + CI | 14% | 13% | 0% | 0% | 9% | 12% | 25% | 16% | 12% | 3% | 8% | 3% |
| CIV le matin de la chirurgie | 9% | 2,5% | 11% | 0% | 2 | 2 | 2% | 9% | 0% | 0% | 3% | 3% |
| CIV + TTT le matin de la chirurgie | 41% | 43% | 24% | 9% | 27 | 24 | 41% | 39% | 20% | 16% | 30% | 21% |
| CI = corticoïdes inhalés, CIV : corticoïdes intra-veineux ; BMAL = béta 2 mimétiques d’action longue, BMAC : béta 2 mimétiques d’action courte ; USI = unité de soins intensifs | ||||||||||||
Tableau 2 : récapitulatif des résultats aux cas cliniques des anesthésistes (AP) versus pneumologues (PP)
Discussion :
Le premier constat de cette étude est qu’il existe une variabilité Intra et inter-spécialité concernant la stratégie de gestion préopératoire des patients asthmatiques :
- Les anesthésistes pédiatres s’accordent plus sur le management de l’enfant d’âge scolaire stable ou partiellement stable ; ou chez qui il existe un antécédent d’hospitalisation en soins intensif.
- La différence entre les deux spécialités est surtout marquée sur l’enfant en âge scolaire ou les pneumologues semblent être plus agressifs notamment pour la prescription de corticoïdes.
- Par contre, les facteurs de risques devant conduire à une augmentation du traitement de fond sont similaires pour les 2 spécialités notamment l’exacerbation récente même si sa définition reste non consensuelle.
La différence des pratiques entre les spécialités peut s’expliquer par la vision chronique pour les pneumologues, qui suivent ces patients au long cours et dont l’objectif est une stabilité de la pathologie. Cette vision est plutôt aigue pour les anesthésistes dont l’objectif est d’éviter une exacerbation aigue ou la survenue de complications respiratoires en période périopératoire. Cela est parfaitement illustré par le fait que, chez les enfants stables d’âge scolaire (considérés comme à moindre risque respiratoire que les plus jeunes), les anesthésistes sont moins agressifs que les pneumologues.
Le fait que l’expérience professionnelle ne modifiait pas l’approche préopératoire de l’optimisation de cette pathologie peut s’expliquer par une transmission des pratiques des anciens vers les plus jeunes. Ceci étant renforcé par l’absence de recommandations.
Concernant les limitations de l’étude, on notera que les données ont été collectés par des cas cliniques théoriques et les médecins peuvent agir différemment au quotidien que par rapport à un scénario précis. Le coté national de l’étude ainsi que la sur spécialisation « pédiatrique » qui s’applique en pneumologie mais pas en anesthésie en Israël (contrairement aux pays Européens) limitent la portée de l’étude au niveau international. Le nombre de praticiens répondeurs (44 anesthésistes sur 24 hôpitaux publiques pour 8 millions d’habitant) paraît faible et on peut douter de la représentativité de l’échantillon. De plus on ne dispose pas d’information sur le nombre d’anesthésiste par hôpital ayant répondu, ni sur leur géographie rurale ou urbaine, ainsi que le volume d’enfants opérés annuel.
L’intérêt de cet article est clairement d’attirer l’attention du praticien anesthésiste-réanimateur sur certains points particuliers : (a) une différence de vision des pratiques entre anesthésistes et Pneumologues, (b) une grande disparité des pratiques anesthésique concernant l’optimisation des patients.
Ceci va clairement en faveur de la création de recommandations professionnelles dans le domaine précis de l’optimisation des enfants asthmatiques en période périopératoire. Un bel exemple de cela a été initié par Lauer et al (3) qui proposent une ébauche d’optimisation préopératoire avec l’utilisation préopératoire de bêta 2 mimétiques et/ou de corticoïdes inhalés ou intraveineux selon le terrain.
Il serait peut-être temps de se pencher sur une standardisation des pratiques en France pour améliorer la prise en charge des enfants asthmatiques.
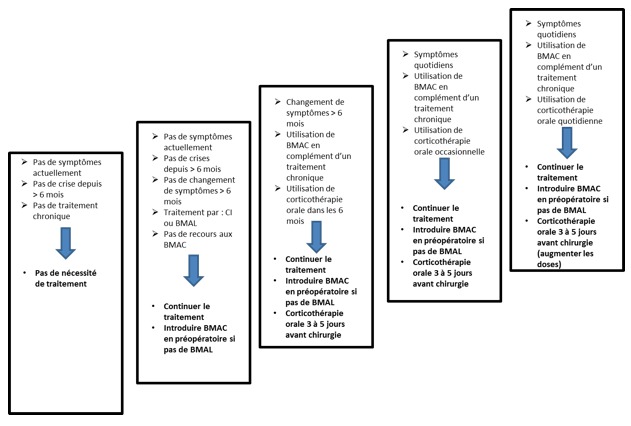
Figure 1 : proposition de gestion préopératoire des traitements au cours de l’asthme chez l’enfant (3)
(CI = corticoïdes inhalés, BMAL = béta 2 mimétiques d’action longue, BMAC : béta 2 mimétiques d’action courte)
Bibliographie:
- Von Ungern-Sternberg BS, Boda K, Chambers NA, Rebmann C, Johnson C, Sly PD, et al. Risk assessment for respiratory complications in paediatric anaesthesia: a prospective cohort study. Lancet 2010;376:773-83.
- Dones F, Foresta G, Russotto V. Update on perioperative management of the child with asthma. Pediatr Rep 2012;2:4(2).
- Lauer R, Vadi M, Mason L. Anaesthetic management of the child with co-existing pulmonary disease. Br J Anaesth 2012;109:i47-59.


