Mis en ligne le 6 Janvier 2014
Questions Fréquentes

Pr Hervé Dupont
Université Jules Verne de Picardie
Pole d’Anesthésie-Réanimation
Centre Hospitalier Universitaire
Place Victor Pauchet
80054 Amiens cedex
Mail : dupont.herve@chu-amiens.fr
1) L’épidémiologie des infections à Candida en réanimation change-t-elle ?
2) Quels sont les facteurs de risque de candidose systémique ?
3) Les signes cliniques et les examens biologiques permettent-ils d’aider au diagnostic de candidémie ?
4) Quels sont les éléments pronostiques des candidémies ?
5) Que faut-il faire du cathéter central en cas de candidémie ?
6) Quelle stratégie thérapeutique pour les candidoses systémiques en réanimation ?
7) Quelles sont les définitions et quelle est la place du traitement préventif en réanimation ?
[hr_shadow]
1) L’épidémiologie des infections à Candida en réanimation change-t-elle ?
Un certain nombre de données, essentiellement nord américaines, laissent supposer qu’il existe une augmentation du nombre d’infections à Candida non albicans par rapport aux souches d’albicans [1]. Les données disponibles en Europe ne vont pas dans ce sens. Une première étude multicentrique dans le sepsis sévère et le choc septique retrouve des proportions de C. albicans à 70% [2], une seconde multicentrique dans les réanimations italiennes à 60% [3] et enfin dans les réanimations françaises à 57% [4]. C. albicans reste donc largement en première position dans l’épidémiologie des candidoses systémiques en Europe. Par contre, depuis 10 ans, une augmentation constante de l’incidence des candidémies est notée en France [5].
2) Quels sont les facteurs de risque de candidose systémique ?
Une revue exhaustive de la littérature a été menée afin d’identifier des facteurs de risque de candidémie en réanimation [6]. De multiples facteurs ont été retrouvés en fonction des études avec comme principale conclusion qu’un patient hospitalisé en réanimation est le plus important des facteurs de risque. L’intensité de la colonisation a été proposée mais elle ne suffit pas pour bien classer les patients les plus à risque de développer une candidose systémique. Un certain nombre de score composites associant des facteurs de risque et la colonisation ont été proposés dont le plus célèbre est le « Candida score » [7]. Il prend en compte l’existence d’une chirurgie, d’une nutrition parentérale totale, d’un sepsis sévère et d’une colonisation multiple. Un score > 2,5 a une sensibilité de 81% et une spécificité de 74%. Dans une nouvelle cohorte de validation, il a été montré que la valeur prédictive négative (VPN) du score était excellente pour exclure la maladie [8]. D’autre scores particulièrement complexes, associant signes cliniques et biologiques ont été proposés, mais s’ils ont tous une VPN très élevée, ils ne permettent pas de sélectionner les patients malades [9]. Concernant les infections intra-abdominales, un score prédictif de présence de levures a été proposé [10]. Il prend en compte la localisation sus-mésocolique de la perforation, l’existence d’une antibiothérapie de plus de 48h en cours, d’un état de choc lors de la chirurgie et le sexe féminin. Un score ≥ 3 a un sensibilité de 84% et une spécificité de 50%. Enfin, la présence d’un examen direct positif à levure dans le liquide péritonéal, témoignant indirectement de l’intensité de l’inoculum, est indépendamment associé à la mortalité dans une série de péritonites graves à levures [11]. Il a été montré récemment dans une population sélectionnée à risque d’infection intra-abdominale post-opératoire, que la présence de 2 valeurs de ß-D-glucane supérieures aux seuils de positivité étaient prédictive d’infection post-opératoire à Candida [12].
3) Les signes cliniques et les examens biologiques permettent-ils d’aider au diagnostic de candidémie ?
Aucun signe clinique n’est formellement associé aux candidoses systémiques. Les atteintes cutanées à type de maculo-papules non prurigineuses, prédominant au niveau du torse et du dos sont inconstantes. Les signes oculaires ne sont retrouvés que dans 16,2% des cas dans la plus grande série publiée [13], mais ils conditionnent la durée de traitement. La détection simultanée d’antigène et d’anticorps semble prometteuse en réanimation, mais elle a surtout une bonne VPN [14]. Les techniques de PCR en temps réel ne sont pas encore standardisées pour être utilisées en routine. L’utilisation de la spectrométrie de masse (maldi-tof) semble prometteuse, avec une forte réduction des délais d’identification et de rendu des résultats [15]. Le dosage de ß-D-glucane dans le sang a surtout un intérêt à l’heure actuelle pour sa forte VPN [14].
4) Quels sont les éléments pronostiques des candidémies ?
Le pronostique global des candidémie n’est pas bon avec une surmortalité attribuable importante de 14,5% et une augmentation de la durée de séjour attribuable de 10 jours dans une étude de registre américaine [16]. Mais une étude européenne multicentrique récente en réanimation ne retrouve pas cette surmortalité [17]. En dehors de la sévérité de la pathologie et de son impact en terme de défaillance d’organe, le délai de mise en route d’un traitement est un facteur indépendant de mortalité dans les candidoses systémiques [18]. Ceci est encore plus marqué pour les patients en choc septique en réanimation [19]. Enfin, il a été montré qu’un traitement antifongique probabiliste inadapté était un facteur de risque indépendant de mortalité sur une série de 199 candidémies [20]. Enfin, il semble exister des différences de pronostic entre les différentes souches de Candida, C. parapsilosis étant associé au meilleur pronostic et C. krusei au moins bon, sans différences entre les autres [21].
5) Que faut-il faire du cathéter central en cas de candidémie ?
Il existe un consensus sur la nécessité d’enlever tout cathéter central lors d’une candidémie chez le patient de réanimation. En effet, l’ablation du cathéter central améliore le taux de succès du traitement [22] et diminue la mortalité [23]. Il ne faut pas oublier de vérifier systématiquement les valves cardiaques à la recherche d’une endocardite [14].
6) Quelle stratégie thérapeutique pour les candidoses systémiques en réanimation ?
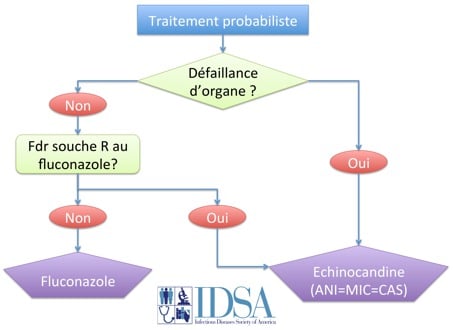
L’amphotéricine B a été pendant longtemps le traitement de référence des candidoses systémiques. Sa toxicité rénale l’a fait abandonner pour des molécules qui n’ont que très peu d’effets secondaires. Les recommandations pragmatiques américaines sont présentées dans la figure ci-dessous [24]. Elles prennent en compte la gravité (défaillance d’organe) et la notion de facteur de risque d’avoir une souche résistante au fluconazole (traitement antérieur par fluconazole, patient immunodéprimé ou d’hématologie, insuffisance rénale chronique dialysée…). Les échinocandines sont en première ligne en réanimation. Les recommandations européennes sont plus radicales puisqu’elles préconisent une échinocandine pour tout le monde en première intention et ce pour une durée de 10 jours [14].
7) Quelles sont les définitions et quelle est la place du traitement préventif en réanimation ?
Un traitement prophylactique est un traitement donné à toute une classe de population comme par exemple les patients de réanimation, les patients d’hématologie, les patients de chirurgie digestive…C’est leur appartenance à ce groupe qui représente leur facteur de risque. Le traitement préemptif est différent : il concerne des patients qui ont un ou plusieurs facteurs de risque de candidose systémique, qui sont colonisés à levures mais qui n’ont pas de signes d’infection. Enfin, le traitement probabiliste concerne des patients à risque colonisés, mais qui ont des signes d’infection systémique. Aucune étude publiée ne démontre l’intérêt du traitement prophylactique ou préemptif en réanimation. Seules des méta-analyses de signification douteuse au vu du nombre d’études publiées concluent à une diminution du nombre d’infections mais sans diminution de mortalité, ce qui est un comble pour ce type de pathologie grave.
Références
[1] Diekema D, Arbefeville S, Boyken L, Kroeger J, Pfaller M. The changing epidemiology of healthcare-associated candidemia over three decades. Diagn Microbiol Infect Dis 2012; 73:45-8.
[2] Vincent JL, Sakr Y, Sprung CL, Ranieri VM, Reinhart K, Gerlach H, et al. Sepsis in European intensive care units: results of the SOAP study. Crit Care Med 2006; 34:344-53.
[3] Tortorano AM, Dho G, Prigitano A, Breda G, Grancini A, Emmi V, et al. Invasive fungal infections in the intensive care unit: a multicentre, prospective, observational study in Italy (2006-2008). Mycoses 2012; 55:73-9.
[4] Leroy O, Gangneux JP, Montravers P, Mira JP, Gouin F, Sollet JP, et al. Epidemiology, management, and risk factors for death of invasive Candida infections in critical care: a multicenter, prospective, observational study in France (2005-2006). Crit Care Med 2009; 37:1612-8.
[5] Bitar D, Lortholary O, Dromer F, Coignard B, Che D. Mycoses invasives en France métropolitaine, PMSI 2001-2010 : incidence, létalité et tendances. Bull Epidemiol Hebd 2013; 12-13:109-14.
[6] Eggimann P, Garbino J, Pittet D. Management of Candida species infections in critically ill patients. Lancet Infect Dis 2003; 3:772-85.
[7] Leon C, Ruiz-Santana S, Saavedra P, Almirante B, Nolla-Salas J, Alvarez-Lerma F, et al. A bedside scoring system (« Candida score ») for early antifungal treatment in nonneutropenic critically ill patients with Candida colonization. Crit Care Med 2006; 34:730-7.
[8] Leon C, Ruiz-Santana S, Saavedra P, Galvan B, Blanco A, Castro C, et al. Usefulness of the « Candida score » for discriminating between Candida colonization and invasive candidiasis in non-neutropenic critically ill patients: a prospective multicenter study. Crit Care Med 2009; 37:1624-33.
[9] Hermsen ED, Zapapas MK, Maiefski M, Rupp ME, Freifeld AG, Kalil AC. Validation and comparison of clinical prediction rules for invasive candidiasis in intensive care unit patients: a matched case-control study. Crit Care 2011; 15:R198.
[10] Dupont H, Bourichon A, Paugam-Burtz C, Mantz J, Desmonts JM. Can yeast isolation in peritoneal fluid be predicted in intensive care unit patients with peritonitis? Crit Care Med 2003; 31:752-7.
[11] Dupont H, Paugam-Burtz C, Muller-Serieys C, Fierobe L, Chosidow D, Marmuse JP, et al. Predictive factors of mortality due to polymicrobial peritonitis with Candida isolation in peritoneal fluid in critically ill patients. Arch Surg 2002; 137:1341-6.
[12] Tissot F, Lamoth F, Hauser PM, Orasch C, Fluckiger U, Siegemund M, et al. Beta-Glucan Antigenemia Anticipates Diagnosis of Blood Culture-Negative Intra-Abdominal Candidiasis. Am J Respir Crit Care Med 2013; 188:1100-9.
[13] Oude Lashof AM, Rothova A, Sobel JD, Ruhnke M, Pappas PG, Viscoli C, et al. Ocular manifestations of candidemia. Clin Infect Dis 2011; 53:262-8.
[14] Cornely OA, Bassetti M, Calandra T, Garbino J, Kullberg BJ, Lortholary O, et al. ESCMID* guideline for the diagnosis and management of Candida diseases 2012: non-neutropenic adult patients. Clin Microbiol Infect 2012; 18 Suppl 7:19-37.
[15] Spanu T, Posteraro B, Fiori B, D’Inzeo T, Campoli S, Ruggeri A, et al. Direct maldi-tof mass spectrometry assay of blood culture broths for rapid identification of Candida species causing bloodstream infections: an observational study in two large microbiology laboratories. J Clin Microbiol 2012; 50:176-9.
[16] Zaoutis TE, Argon J, Chu J, Berlin JA, Walsh TJ, Feudtner C. The epidemiology and attributable outcomes of candidemia in adults and children hospitalized in the United States: a propensity analysis. Clin Infect Dis 2005; 41:1232-9.
[17] Gonzalez de Molina FJ, Leon C, Ruiz-Santana S, Saavedra P, the CISG. Assessment of candidemia-attributable mortality in critically ill patients using propensity score matching analysis. Crit Care 2012; 16:R105.
[18] Garey KW, Rege M, Pai MP, Mingo DE, Suda KJ, Turpin RS, et al. Time to initiation of fluconazole therapy impacts mortality in patients with candidemia: a multi-institutional study. Clin Infect Dis 2006; 43:25-31.
[19] Kollef M, Micek S, Hampton N, Doherty JA, Kumar A. Septic shock attributed to Candida infection: importance of empiric therapy and source control. Clin Infect Dis 2012; 54:1739-46.
[20] Parkins MD, Sabuda DM, Elsayed S, Laupland KB. Adequacy of empirical antifungal therapy and effect on outcome among patients with invasive Candida species infections. J Antimicrob Chemother 2007; 60:613-8.
[21] Horn DL, Neofytos D, Anaissie EJ, Fishman JA, Steinbach WJ, Olyaei AJ, et al. Epidemiology and outcomes of candidemia in 2019 patients: data from the prospective antifungal therapy alliance registry. Clin Infect Dis 2009; 48:1695-703.
[22] Andes DR, Safdar N, Baddley JW, Playford G, Reboli AC, Rex JH, et al. Impact of treatment strategy on outcomes in patients with candidemia and other forms of invasive candidiasis: a patient-level quantitative review of randomized trials. Clin Infect Dis 2012; 54:1110-22.
[23] Garnacho-Montero J, Diaz-Martin A, Garcia-Cabrera E, Ruiz Perez de Pipaon M, Hernandez-Caballero C, Lepe-Jimenez JA. Impact on hospital mortality of catheter removal and adequate antifungal therapy in Candida spp. bloodstream infections. J Antimicrob Chemother 2013; 68:206-13.
[24] Pappas PG, Kauffman CA, Andes D, Benjamin DK, Jr., Calandra TF, Edwards JE, Jr., et al. Clinical practice guidelines for the management of candidiasis: 2009 update by the Infectious Diseases Society of America. Clin Infect Dis 2009; 48:503-35.


