Jean-Luc Fellahi1,2, Rémi Schweizer1
1 Service d’anesthésie-réanimation, Hôpital Universitaire Louis-Pradel, Hospices civils de Lyon, 59, boulevard Pinel, 69394 Lyon cedex, France
2 Laboratoire CarMeN, Inserm UMR 1060, Université Claude Bernard Lyon 1, Lyon, France
Auteur correspondant : Pr Jean-Luc FELLAHI, Service d’Anesthésie-Réanimation, Hôpital Louis-Pradel, Hospices civils de Lyon, 59, boulevard Pinel, 69500 Lyon, France
Tel : 0472118933 ; Email : jean-luc.fellahi@chu-lyon.fr
Les auteurs déclarent ne pas avoir de liens d’intérêts.
Résumé
L’évaluation préopératoire du risque cardiovasculaire est essentielle pour réduire la morbimortalité périopératoire en France où près de la moitié des patients âgés de plus de 45 ans ont des facteurs de risque cardiovasculaires. La place de l’anesthésiste-réanimateur est primordiale tandis que les critères faisant intervenir le cardiologue sont plus limités. Si les recommandations françaises datant de 2011 restent globalement d’actualité pour la pratique quotidienne, les dernières recommandations européennes publiées en 2022 et 2023 proposent certaines modifications qui posent question. Une attitude systématique adoptant en routine les six règles décrites semble un compromis à la fois raisonnable et pragmatique en 2024.
Mots clés : Biomarqueurs cardiaques, Dommage myocardique, Echocardiographie, Fragilité, Score de Lee.
Abstract
Preoperative cardiac risk evaluation is of paramount importance to reduce major perioperative cardiac events and mortality after non-cardiac surgery. If the anesthesiologist plays a pivotal role, the additional value of the cardiologist is more restricted. Nowadays, the joint French guidelines published in 2011 are still of interest for routine practice but the recent recommendations from both the European Society of Cardiology and the European Society of Anesthesiology and Intensive Care highlight some important issues that ask crucial questions. A systematic approach using the six rules described in that review is a reasonable and pragmatic compromise in 2024 that could help careproviders at the bedside.
Keywords: Cardiac biomarkers; myocardial damage; echocardiography; frailty; Revised Cardiac Risk Index.
Introduction
La prise en charge du patient à risque cardiaque représente un bon modèle de ce que doit être la médecine périopératoire et un véritable défi pour l’anesthésiste-réanimateur moderne. De plus en plus fréquents, ces patients sont exposés au risque de survenue d’un dommage myocardique postopératoire (MINS pour Myocardial Injury after Noncardiac Surgery) dont les conséquences en termes de surmorbi-mortalité ne sont plus à démontrer [1]. La première phase de leur prise en charge consiste en une évaluation et une stratification préopératoire du risque dont les bases ont été définies conjointement en 2011 par les sociétés françaises d’anesthésie-réanimation (SFAR) et de cardiologie (SFC) en tenant compte des spécificités du système de soins français, notamment l’existence d’une consultation d’anesthésie obligatoire [2]. L’intérêt pour la pratique quotidienne de ces recommandations nationales a été rappelé dans une revue générale publiée après la journée monothématique de la SFAR dédiée au sujet en 2017 [3]. Elles sont aujourd’hui bousculées par les recommandations récentes des sociétés savantes européennes de cardiologie et d’anesthésie-réanimation [4,5]. Une approche systématique fondée sur 6 règles raisonnables et pragmatiques doit permettre d’intégrer en routine l’évaluation et la stratification préopératoire du risque cardiaque en chirurgie non cardiaque programmée.
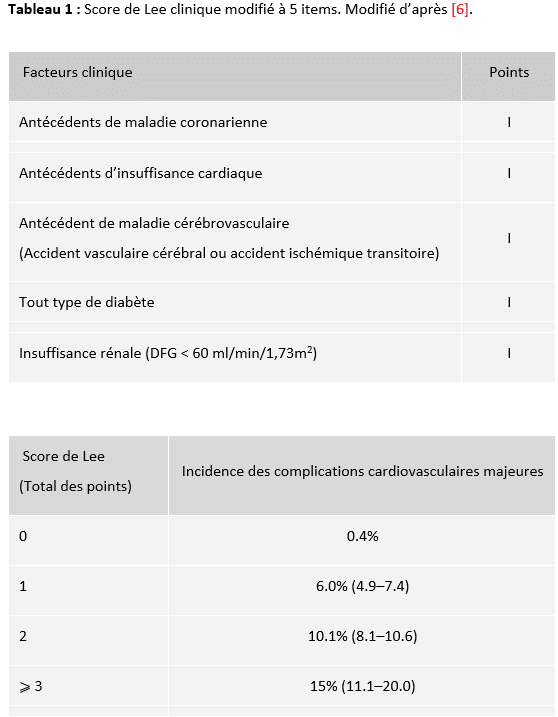
Règle numéro 1 : évaluer le risque lié au patient par le score de Lee clinique modifié
Validé initialement en 1999 pour tous les types de chirurgie non cardiaque, le score de Lee, version modifiée de l’index original de Goldman, encore appelé Revised Cardiac Risk Index, reste le plus utilisé [6]. Revalidé en 2015 sur une cohorte de 450 000 patients, il est simple et robuste et sa valeur prédictive négative est excellente, c’est-à-dire qu’en cas de score égal à zéro, le risque de complications cardiovasculaires est quasi nul [7]. Il est conseillé d’utiliser aujourd’hui en routine le score clinique modifié à 5 items (Tableau 1). Etonnamment, les dernières recommandations européennes se sont prononcées en défaveur des scores de risque pour l’évaluation préopératoire (y compris le score de Lee), leur préférant le jugement du praticien fondé sur l’anamnèse et l’examen clinique [4]. Une telle pratique risque cependant d’introduire une variabilité importante dans l’évaluation préopératoire des patients et de fragiliser les organisations imposées par le travail en équipe, l’anesthésiste-réanimateur qui prend en charge le patient au bloc opératoire étant rarement celui qui a réalisé l’évaluation préopératoire lors de la consultation.
Notre avis : Il semble raisonnable et pragmatique en 2024 de continuer à privilégier le score de Lee clinique pour l’évaluation du risque lié au patient.
Règle numéro 2 : évaluer le risque lié à la chirurgie
Il est habituel de séparer les chirurgies non cardiaques en 3 catégories selon l’incidence des complications cardiaques majeures survenant dans les 30 premiers jours postopératoires :
- chirurgie à risque faible : incidence inférieure à 1% ;
- chirurgie à risque intermédiaire : incidence comprise entre 1 et 5% ;
- chirurgie à risque élevé ; incidence supérieure à 5%.
Les dernières recommandations européennes ont actualisé le tableau des interventions et intégré de nouveaux libellés (Tableau 2) [4]. Si cette liste a le mérite d’exister, elle demeure malheureusement non exhaustive et peut conduire les praticiens à mal évaluer ou ne pas évaluer le risque lié à la chirurgie lorsque l’intervention prévue ne figure pas explicitement dans le tableau [8].
Notre avis : Il semble raisonnable et pragmatique en 2024 d’évaluer le risque lié à la chirurgie à l’aide du tableau actualisé dans les dernières recommandations européennes.
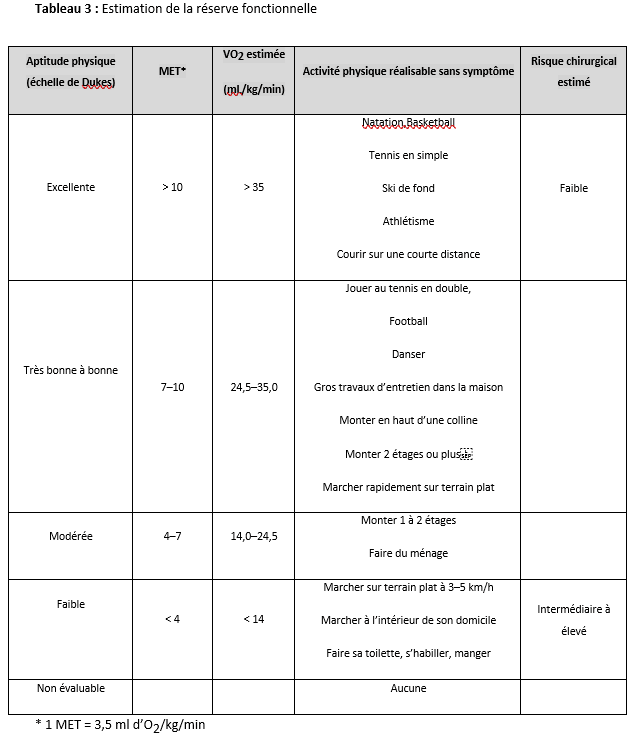
Règle numéro 3 : évaluer la réserve fonctionnelle du patient
L’estimation de la réserve fonctionnelle permet d’évaluer la sévérité d’une maladie coronaire ou d’une insuffisance cardiaque chez des patients symptomatiques ou bien de dépister une coronaropathie chez un patient asymptomatique présentant des facteurs de risque. Elle peut être mesurée lors d’une épreuve d’effort cardiorespiratoire (VO2max) ou plus souvent estimée par l’interrogatoire du patient ou à l’aide d’un questionnaire standardisé. Elle est exprimée en équivalents métaboliques (MET), 1 MET correspondant à une VO2 de 3,5 ml/kg/min, soit la consommation d’oxygène de base au repos d’un sujet de 70 ans pesant 70 kg. Elle est considérée comme excellente > 10 MET, bonne entre 7 et 10 MET, moyenne entre 4 et 6 MET, et pauvre < 4 MET. La capacité auto déclarée par le patient à monter 2 étages sans essoufflement correspond à au moins 4 MET (Tableau 3). Longtemps débattue dans la littérature médicale pour son caractère simpliste, cette approche clinique rudimentaire a été revalidée récemment sur une importante cohorte prospective de patients à haut risque [9]. Elle fait désormais l’objet d’une recommandation de classe IIa (niveau de preuve B) dans les recommandations européennes [4]. L’utilisation d’un questionnaire standardisé pourrait permettre une meilleure évaluation de la réserve fonctionnelle. Notre équipe a validé récemment une version française du Duke Activity Statut Index (F-DASI) dont la discrimination pour identifier le risque de complications cardiaques postopératoires est supérieure à la capacité auto déclarée par les patients à monter deux étages. Le F-DASI pourrait à cet égard représenter une alternative valable pour la pratique quotidienne [10].
Notre avis : Il semble raisonnable et pragmatique en 2024 d’évaluer la réserve fonctionnelle du patient à l’aide de la capacité auto déclarée à monter au moins deux étages ou du questionnaire F-DASI.
Règle numéro 4 : évaluer la fragilité du patient âgé
Un patient fragile accuse une baisse de résistance au stress par diminution des réserves fonctionnelles physiques, physiologiques et psychosociales. La prévalence de la fragilité augmente avec l’âge. Elle est plus élevée, à âge équivalent, chez les patients chirurgicaux. Elle est statistiquement associée à un risque accru de morbidité majeure, de mortalité et de dépendance fonctionnelle à long terme. Il est désormais recommandé (classe IIa, niveau de preuve B) de la dépister chez les patients âgés de plus de 70 ans programmés pour une chirurgie à risque intermédiaire ou élevé [4]. Différents outils ont été publiés dans la littérature. L’index de fragilité canadien et l’indice de Fried sont en pratique les plus utilisés [11,12]. Si le principe même du dépistage de la fragilité semble logique, sa mise en œuvre en routine est assez complexe. Faut-il que les anesthésistes-réanimateurs s’approprient ces échelles et les utilisent lors de la consultation d’anesthésie ? Faut-il mettre en place un réseau fonctionnel et travailler avec une équipe mobile de gériatrie ? Quels sont les délais acceptables pour ne pas trop retarder une chirurgie programmée ? Quel impact à terme sur la morbimortalité de ces patients étiquetés « fragiles » ? Autant de questions auxquelles il est difficile de répondre clairement aujourd’hui. Enfin, la fragilité ne prédit pas spécifiquement le risque de survenue d’un MINS ni celui de complications cardiaques graves postopératoires.
Notre avis : S’il semble raisonnable en 2024 d’évaluer la fragilité des patients chirurgicaux âgés de plus de 70 ans, sa mise en œuvre en routine pose de nombreuses questions conceptuelles et organisationnelles non encore résolues.
Règle numéro 5 : utiliser l’échocardiographie de repos avec modération
L’échocardiographie transthoracique de repos (ETT) est simple et facilement accessible. Son intérêt réside surtout dans l’évaluation des valvulopathies dont l’impact sur la morbidité cardiaque peut être sous-estimé. Les dernières recommandations européennes proposent une très importante libéralisation du recours préopératoire à l’ETT (classe I à IIa/IIb, niveau de preuve B) chez les patients avec une faible réserve fonctionnelle et/ou une augmentation du NT-proBNP/BNP ou si un souffle cardiaque ou une dyspnée inexpliquée sont détectés avant une chirurgie non cardiaque à risque élevé ou modéré [4]. Pourtant, les anomalies morphologiques ou fonctionnelles détectées par l’ETT ne sont pas prédictives du risque cardiovasculaire périopératoire et l’ETT avant une chirurgie à haut risque ne réduit pas le risque cardiovasculaire dans les grandes séries rétrospectives de la littérature [13-15]. Conscients des difficultés organisationnelles prévisibles en rapport avec cette extension importante des indications, et afin de ne pas saturer les laboratoires d’échocardiographie et de ne pas retarder les interventions chirurgicales programmées, les experts ouvrent la boite de Pandore et suggèrent la possibilité d’une échographie FOCUS réalisée par des non cardiologues (autrement dit des anesthésistes-réanimateurs) pour l’évaluation préopératoire (classe IIb, niveau de preuve B). Un important essai européen randomisé et multicentrique (EuPreCHO) devrait débuter en 2024 et apporter dans les prochaines années une réponse claire sur la place réelle de l’ETT dans l’évaluation et la stratification préopératoire du risque cardiaque.
Notre avis : Vus le faible niveau de preuve dans la littérature actuelle et les difficultés organisationnelles majeures prévisibles, il semble raisonnable et pragmatique en 2024 de rester sur une utilisation restrictive et individuelle de l’ETT préopératoire.
Règle numéro 6 : limiter le recours aux biomarqueurs cardiaques
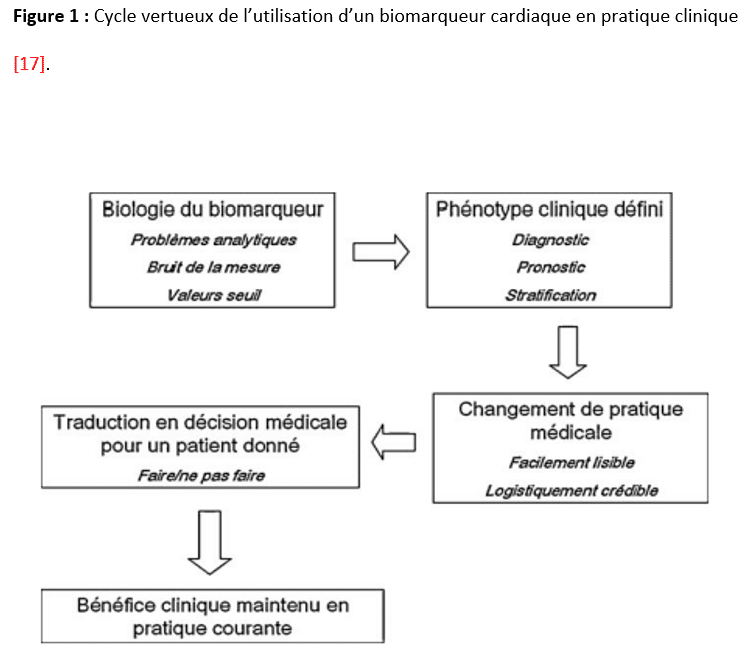
Si les recommandations européennes de 2014 préconisaient un recours raisonnable et raisonné aux dosages des biomarqueurs cardiaques [16], celles de 2022 prônent à l’inverse une libéralisation massive de l’utilisation périopératoire des troponines et des peptides natriurétiques dans les chirurgies à risque intermédiaire et élevé (classe I et IIa, niveau de preuve B), en plus de la réalisation préopératoire d’un électrocardiogramme de repos [4]. Au-delà de l’engouement des cliniciens pour les biomarqueurs et des inévitables conséquences financières qui en découlent, il semble essentiel de définir un cercle vertueux de l’utilisation de ces biomarqueurs cardiaques, précisant bien les changements significatifs de pratique médicale attendus (Figure 1) [17]. Ainsi, si une association forte et indépendante entre une élévation pré- et/ou postopératoire de troponine I/T ou de BNP/NT-proBNP a bien été rapportée à de nombreuses reprises dans la littérature, il n’y a pas de preuve robuste et convaincante d’une diminution du sur-risque identifié découlant d’une prise en charge thérapeutique spécifique et agressive du MINS. Un seul essai international, randomisé et multicentrique a montré une réduction significative des complications cardiovasculaires postopératoires lorsque du dabigatran était introduit à la dose de 110 mg x2/j chez les patients à faible risque hémorragique développant un MINS après chirurgie non cardiaque [18]. Cette option thérapeutique que personne n’utilise en routine fait désormais l’objet d’une recommandation faible (classe IIb, niveau de preuve B) [4]. Une ré analyse exhaustive, rigoureuse et pragmatique de l’ensemble de la littérature a été proposée en 2023 par un groupe d’experts de l’European Society of Anaesthesiology and Intensive Care pour tenter de répondre à la question « comment et quand utiliser en routine les biomarqueurs cardiaques en chirurgie non cardiaque » [5]. Séparant les périodes pré- et postopératoire et distinguant une utilisation des biomarqueurs cardiaques à visée prédictive, pronostique ou susceptible de modifier les soins proposés aux patients, ces nouvelles recommandations ne peuvent que constater une qualité d’évidence au mieux modérée mais souvent faible à très faible, débouchant sur des recommandations faibles ou sur l’absence de recommandations [5]. La publication finale propose en appendice un abstract graphique synthétique très visuel qui résume l’attitude à adopter en pratique clinique.
Notre avis : Vus le faible niveau de preuve dans la littérature actuelle de la capacité des biomarqueurs cardiaques à modifier la prise en charge des patients et les surcoûts majeurs prévisibles, il semble raisonnable et pragmatique en 2024 de rester sur une utilisation restrictive et individuelle des biomarqueurs cardiaques.
Conclusions
Les complications cardiovasculaires postopératoires sont fréquentes et l’évaluation et la stratification du risque avant une chirurgie non cardiaque programmée constituent la première étape indispensable d’une stratégie globale de prise en charge périopératoire du patient à risque cardiaque. Une attitude systématique adoptant en routine les six règles décrites semble un compromis à la fois raisonnable et pragmatique en 2024.
Références
- Botto F, Alonso-Coello P, Chan MT, Villar JC, Xavier D, Srinathan S, et al. Myocardial injury after noncardiac surgery: a large, international, prospective cohort study establishing diagnostic criteria, characteristics, predictors, and 30-day Outcomes. Anesthesiology 2014;120:564-78.
- Société française d’anesthésie et de réanimation (Sfar); Société française de cardiologie (SFC). Perioperative assessment of cardiac risk patient in non-cardiac surgery. Ann Fr Anesth Reanim 2011;30:e5‑
- Fellahi JL, Godier A, Benchetrit D, Berthier F, Besch G, Bochaton T, et al. Perioperative management of patients with coronary artery disease undergoing non-cardiac surgery: Summary from the French Society of Anaesthesia and Intensive Care Medicine 2017 convention. Anaesth Crit Care Pain Med 2018;37:367‑
- Halvorsen S, Mehilli J, Cassese S, Hall TS, Abdelhamid M, Barbato E, et al. 2022 ESC guidelines on cardiovascular assessment and management of patients undergoing non-cardiac surgery. Eur Heart J 2022;43:3826-924.
- Lurati-Buse G, Pinto BB, Abelha F, Abbott TEF, Ackland G, Afshari A, et al. ESAIC focused guideline for the use of cardiac biomarkers in perioperative risk evaluation. Eur J Anaesthesiol 2023;40:888-927.
- Lee TH, Marcantonio ER, Mangione CM, Thomas EJ, Polanczyk CA, Cook EF, et al. Derivation and Prospective Validation of a Simple Index for Prediction of Cardiac Risk of Major Noncardiac Surgery. Circulation 1999;100:1043‑
- Andersson C, Wissenberg M, Jørgensen ME, Hlatky MA, Mérie C, Jensen PF, et al. Age-Specific Performance of the Revised Cardiac Risk Index for Predicting Cardiovascular Risk in Elective Noncardiac Surgery. Circ Cardiovasc Qual Outcomes 2015;8:103‑
- Schweizer R, Jacquet-Lagreze M, Fellahi JL. Implementation of 2022 ESC guidelines for cardiovascular assessment before non-cardiac surgery: Major concerns to meet in the near future! Eur J Anaesthesiol 2023;40:385-6.
- Lurati Buse GAL, Puelacher C, Gualandro DM, Genini AS, Hidvegi R, Bolliger D, et al. Association between self-reported functional capacity and major adverse cardiac events in patients at elevated risk undergoing noncardiac surgery: a prospective diagnostic cohort study. Bri J Anaesth 2021;126:102‑
- Louyot C, Portran P, Schweizer R, Glerant JC, Thivolet S, Brassart O, et al. Elaboration of a French version of the Duke Activity Statut Index questionnaire and performance to predict functional capacity. Anaesth Crit Care Pain Med 2023;42:101199.
- Fried LP, Tangen CM, Walston J, Newman AB, Hirsch C, Gottdiener J, et al. Frailty in Older Adults: Evidence for a Phenotype. J Gerontol A Biol Sci Med Sci 2001;56:M146–57.
- Rockwood K. A global clinical measure of fitness and frailty in elderly people. CMAJ 2005;173:489‑
- Wijeysundera DN, Beattie WS, Karkouti K, Neuman MD, Austin PC, Laupacis A. Association of echocardiography before major elective non-cardiac surgery with postoperative survival and length of hospital stay: population based cohort study. BMJ 2011;342:d369.
- Levitan EB, Graham LA, Valle JA, Richman JS, Hollis R, Holcomb CN, et al. Pre-operative echocardiography among patients with coronary artery disease in the United States Veterans Affairs healthcare system: A retrospective cohort study. BMC Cardiovasc Disord 2016;16:173.
- Chang HY, Chang WT, Liu YW. Application of transthoracic echocardiography in patients receiving intermediate- or high-risk noncardiac surgery. Vallabhajosyula S. PLoS ONE 2019;14:e0215854.
- 2014 ESC/ESA Guidelines on non-cardiac surgery: cardiovascular assessment and management: The Joint Task Force on non-cardiac surgery: cardiovascular assessment and management of the European Society of Cardiology (ESC) and the European Society of Anaesthesiology (ESA). Eur Heart J 2014;35:2383‑
- Fellahi JL, Piriou V, Longrois D. Cardiac biomarkers in perioperative risk stratification. Ann Fr Anesth Reanim 2011;30:126-40.
- Devereaux PJ, Duceppe E, Guyatt E, Tandon V, Rodseth R, Biccard BM, et al. Dabigatran in patients with myocardial injury after non-cardiac surgery (MANAGE): an international, randomized, placebo-controlled trial. Lancet 2018;391:2325-34.
Quelle que soit la raison pour laquelle le dosage d’un biomarqueur cardiaque est envisagé, le changement de pratique médicale attendu doit être visible et crédible. Il doit en outre avoir une traduction en décision médicale claire et bénéfique pour un patient donné.