Mis en ligne le 29 Novembre 2014
Questions Fréquentes

Dr Frédéric Pène
Réanimation médicale, hôpital Cochin, AP-HP, Paris
Université Paris Descartes
frederic.pene@cch.aphp.fr
Question 1 : Comment diagnostiquer une MAT ?
Question 2 : Quelle est la classification actuelle des MAT ?
Question 3 : Quel bilan paraclinique faut-il réaliser?
Question 4 : Quel traitement spécifique pour la MAT ?
Question 5 : Quel traitement symptomatique de la MAT ?
[hr_shadow]
Question 1 : Comment diagnostiquer une MAT ?
Les microangiopathies thrombotiques (MAT) sont des pathologies rares dues à la constitution rapide de thrombi artériolaires entrainant une ischémie viscérale, associées à une bicytopénie sous la forme d’une thrombopénie de consommation et d’une anémie hémolytique mécanique.
Les atteintes neurologique et rénale sont caractéristiques et déterminent les entités de purpura thrombotique thrombocytopénique (PTT) (avec des manifestations neurologiques polymorphes et parfois fluctuantes) et de syndrome hémolytique et urémique (SHU) (où l’atteinte rénale est liée à une néphropathie vasculaire, parfois associée à une glomérulopathie). Cette distinction nosologique classique est fréquemment mise en défaut par l’association de manifestations rénales et neurologiques et a maintenant laissé place à une classification physiopathologique (cf. question 2).
En outre il convient de souligner que l’atteinte cardiaque est fréquente sous la forme de phénomènes ischémiques microvasculaires. L’augmentation des LDH traduit essentiellement l’ischémie tissulaire.
En l’absence de cause alternative évidente, l’association d’une thrombopénie et d’une anémie hémolytique schizocytaire est suffisante pour porter un diagnostic présomptif de MAT et initier un traitement spécifique en urgence.
Les principaux diagnostics différentiels à évoquer sont l’accès palustre, le syndrome d’Evans, le HELLP (Hemolysis Elevated Liver enzymes Low Platelets) syndrome au cours de la grossesse.
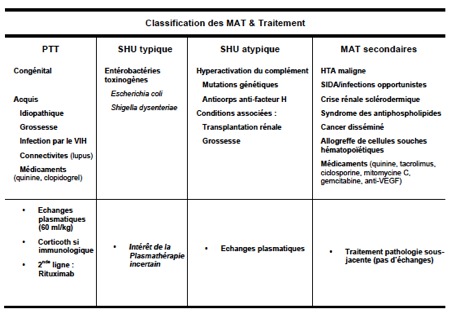
Question 2 : Quelle est la classification actuelle des MAT ?
Malgré des manifestations cliniques et biologiques communes, les MAT se caractérisent par des mécanismes physiopathologiques différents. Les avancées récentes dans leur compréhension ont permis d’établir une classification physiopathologique des MAT avec des implications thérapeutiques directes (Cf Tableau).
· Le PTT est lié à un déficit profond (<10%) de la protéase de clivage du vWF appelée ADAMTS13 (A Disintegrin And Metalloproteinase with ThromboSpondin-1 motif [13ème membre de la famille]), causé par des mutations génétiques (syndrome d’Upshaw-Schulmann chez l’enfant), ou plus souvent chez l’adulte par des auto-anticorps inhibiteurs acquis [1-3].
· Le SHU typique post- diarrhéique est causé par une toxine bactérienne (également appelée verotoxine ou shigatoxine) produite par certaines entérobactéries (ex: Escherichia coli de sérotype O157:H7, ou O104:H4 dans la récente épidémie allemande), souvent dans un contexte épidémique [4, 5].
· Le SHU atypique est généralement liée à une activation non contrôlée du complément causée par un déficit congénital ou acquis de protéines inhibitrices de la voie alterne du complément [6, 7].
· Enfin, les syndromes de MAT secondaires sont associés à diverses situations cliniques et semblent essentiellement liées à une agression endothéliale [8].
Question 3 : Quel bilan paraclinique faut-il réaliser?
Le bilan est nécessaire pour affirmer le diagnostic, éliminer les principaux diagnostics différentiels, rechercher l’étiologie et les mécanismes physiopathologiques. La recherche d’une infection associée, particulièrement fréquente dans ce contexte, doit être systématique. Tous les prélèvements sanguins et une sérothèque congelée doivent impérativement être réalisés avant toute plasmaphérèse et tout apport de plasma exogène.
- Affirmer le diagnostic
- Numération formule sanguine, avec numération des réticulocytes
- Pourcentage de schizocytes sur le frottis sanguin (normal < 1% des hématies)
- Bilan des atteintes viscérales
- Créatinine, bandelette urinaire, ECBU, protéinurie
- Imagerie cérébrale (IRM+++) si point d’appel clinique*
- ECG, troponine
- Recherche d’un diagnostic différentiel
- Test de Coombs direct
- Recherche de Plasmodium*
- Recherches étiologiques
- Sérologie VIH
- Hémoculture et ECBU
- Facteurs anti-nucléaires, anticorps antiphospholipides
- Coproculture et PCR shigatoxine si diarrhée*
- Dosage de l’activité ADAMTS13 et recherche d’anticorps inhibiteurs
- Recherche de mutations génétiques des protéines du complément
- Recherche d’anticorps anti-facteur H
- Sérothèque congelée
- Examens pré-transfusionnels
- Groupe Rhesus, phénotype érythrocytaire
- Recherche d’agglutinines irrégulières
* A réaliser en cas de point d’appel
Question 4 : Quel traitement spécifique pour la MAT ?
L’apport de plasma exogène par échange plasmatique représente l’élément principal du traitement du PTT et a littéralement transformé le pronostic de cette pathologie dont le taux de mortalité est maintenant inférieur à 10%, contre 90% en l’absence de traitement [9].
Le SHU atypique représente également une indication formelle de plasmathérapie. L’intérêt des échanges plasmatiques est discuté dans le SHU typique post-diarrhéique avec manifestations neurologiques.
Les échanges plasmatiques sont inefficaces dans les MAT secondaires dont le traitement ne relève que de celui de la pathologie sous-jacente.
L’échange plasmatique associe une plasmaphérèse avec une compensation par du plasma frais congelé à la dose de 60 mL/kg, et peut être réalisé par centrifugation sur des machines dédiées, ou par filtration sur des machines d’épuration extra-rénale de réanimation. Les échanges plasmatiques par centrifugation peuvent parfois être réalisés sur deux voies veineuses périphériques de bon calibre, mais nécessitent le plus souvent la mise en place d’un cathéter central.
La perfusion de plasma à la dose de 20-30 mL/kg constitue une alternative thérapeutique acceptable, mais temporaire car d’efficacité moindre et fréquemment limitée par la surcharge volémique [10]. En pratique, la plasmathérapie par échange plasmatique doit être débutée en urgence après réalisation des prélèvements sanguins. A défaut, la perfusion de plasma doit être débutée dans l’attente d’un transfert vers un centre à même de réaliser cette procédure. En début de traitement, la fréquence des échanges plasmatiques est quotidienne. La rémission est caractérisée par la normalisation du taux de plaquettes et de LDH et sur l’arrêt de l’hémolyse pendant deux jours consécutifs, elle permet alors une diminution progressive du rythme des échanges plasmatiques.
Le PTT d’origine immunologique justifie d’un traitement immunosuppresseur par corticoïdes [11]. Le rituximab (MabTheraÒ) est actuellement indiqué en cas de PTT résistant ou récidivant malgré les échanges plasmatiques [12]. L’administration de cyclophosphamide ou la splénectomie représentent des alternatives thérapeutiques de troisième ligne [13]. L’eculizumab (SolirisÒ), anticorps dirigé contre la fraction C5 du complément, est indiqué comme traitement adjuvant du SHU atypique [14]. Les indications de ces différents traitements devront être discutées avec le centre de compétence local de ces pathologies.
Question 5 : Quel traitement symptomatique de la MAT ?
La prise en charge initiale est réalisée en réanimation ou en unité de soins continus, où sont réunies les ressources thérapeutiques et les conditions de surveillance des dysfonctions neurologique, cardiaque et rénale d’évolution souvent imprévisible.
Le contrôle tensionnel revêt une importance particulière dans ce contexte, l’hypertension étant susceptible d’entretenir l’agression endothéliale. Les inhibiteurs de l’enzyme de conversion de demi-vie courte sont utilisés en première intention, même en cas d’insuffisance rénale, en raison du caractère rénine-dépendant de l’HTA.
L’administration de folates est systématique comme dans ce contexte d’anémie hémolytique.
La transfusion préventive de plaquettes est contre-indiquée, même en cas de thrombopénie profonde ou de procédures invasives [15]. En effet elle est susceptible d’aggraver le phénomène thrombogène et a été associée à des aggravations neurologiques et des morts subites. Seules les hémorragies engageant le pronostic vital ou fonctionnel peuvent justifier de transfusions plaquettaires curatives encadrées par des échanges plasmatiques.
Références
1. Furlan M, Robles R, Galbusera M, Remuzzi G, Kyrle PA, Brenner B, Krause M, Scharrer I, Aumann V, Mittler U, Solenthaler M, Lammle B, (1998) von Willebrand factor-cleaving protease in thrombotic thrombocytopenic purpura and the hemolytic-uremic syndrome. N Engl J Med 339: 1578-1584.
2. Tsai HM, Lian EC, (1998) Antibodies to von Willebrand factor-cleaving protease in acute thrombotic thrombocytopenic purpura. N Engl J Med 339: 1585-1594.
3. Coppo P, Veyradier A, (2012) Current management and therapeutical perspectives in thrombotic thrombocytopenic purpura. Presse Med 41: e163-176
4. Frank C, Werber D, Cramer JP, Askar M, Faber M, an der Heiden M, Bernard H, Fruth A, Prager R, Spode A, Wadl M, Zoufaly A, Jordan S, Kemper MJ, Follin P, Muller L, King LA, Rosner B, Buchholz U, Stark K, Krause G, (2011) Epidemic profile of Shiga-toxin-producing Escherichia coli O104:H4 outbreak in Germany. N Engl J Med 365: 1771-1780
5. Buchholz U, Bernard H, Werber D, Bohmer MM, Remschmidt C, Wilking H, Delere Y, an der Heiden M, Adlhoch C, Dreesman J, Ehlers J, Ethelberg S, Faber M, Frank C, Fricke G, Greiner M, Hohle M, Ivarsson S, Jark U, Kirchner M, Koch J, Krause G, Luber P, Rosner B, Stark K, Kuhne M, (2011) German outbreak of Escherichia coli O104:H4 associated with sprouts. N Engl J Med 365: 1763-1770
6. Malina M, Roumenina LT, Seeman T, Le Quintrec M, Dragon-Durey MA, Schaefer F, Fremeaux-Bacchi V, (2012) Genetics of hemolytic uremic syndromes. Presse Med 41: e105-114
7. Dragon-Durey MA, Sethi SK, Bagga A, Blanc C, Blouin J, Ranchin B, Andre JL, Takagi N, Cheong HI, Hari P, Le Quintrec M, Niaudet P, Loirat C, Fridman WH, Fremeaux-Bacchi V, (2010) Clinical features of anti-factor H autoantibody-associated hemolytic uremic syndrome. J Am Soc Nephrol 21: 2180-2187
8. George JN, Terrell DR, Vesely SK, Kremer Hovinga JA, Lammle B, (2012) Thrombotic microangiopathic syndromes associated with drugs, HIV infection, hematopoietic stem cell transplantation and cancer. Presse Med 41: e177-188
9. Rock GA, Shumak KH, Buskard NA, Blanchette VS, Kelton JG, Nair RC, Spasoff RA, (1991) Comparison of plasma exchange with plasma infusion in the treatment of thrombotic thrombocytopenic purpura. Canadian Apheresis Study Group. N Engl J Med 325: 393-397.
10. Coppo P, Bussel A, Charrier S, Adrie C, Galicier L, Boulanger E, Veyradier A, Leblanc T, Alberti C, Azoulay E, Le Gall JR, Schlemmer B, (2003) High-dose plasma infusion versus plasma exchange as early treatment of thrombotic thrombocytopenic purpura/hemolytic-uremic syndrome. Medicine (Baltimore) 82: 27-38.
11. Bell WR, Braine HG, Ness PM, Kickler TS, (1991) Improved survival in thrombotic thrombocytopenic purpura-hemolytic uremic syndrome. Clinical experience in 108 patients. N Engl J Med 325: 398-403.
12. Froissart A, Buffet M, Veyradier A, Poullin P, Provot F, Malot S, Schwarzinger M, Galicier L, Vanhille P, Vernant JP, Bordessoule D, Guidet B, Azoulay E, Mariotte E, Rondeau E, Mira JP, Wynckel A, Clabault K, Choukroun G, Presne C, Pourrat J, Hamidou M, Coppo P, (2012) Efficacy and safety of first-line rituximab in severe, acquired thrombotic thrombocytopenic purpura with a suboptimal response to plasma exchange. Experience of the French Thrombotic Microangiopathies Reference Center. Crit Care Med 40: 104-111
13. Beloncle F, Buffet M, Coindre JP, Munoz-Bongrand N, Malot S, Pene F, Mira JP, Galicier L, Guidet B, Baudel JL, Subra JF, Tanguy-Schmidt A, Pourrat J, Azoulay E, Veyradier A, Coppo P, (2012) Splenectomy and/or cyclophosphamide as salvage therapies in thrombotic thrombocytopenic purpura: the French TMA Reference Center experience. Transfusion
14. Legendre CM, Licht C, Muus P, Greenbaum LA, Babu S, Bedrosian C, Bingham C, Cohen DJ, Delmas Y, Douglas K, Eitner F, Feldkamp T, Fouque D, Furman RR, Gaber O, Herthelius M, Hourmant M, Karpman D, Lebranchu Y, Mariat C, Menne J, Moulin B, Nurnberger J, Ogawa M, Remuzzi G, Richard T, Sberro-Soussan R, Severino B, Sheerin NS, Trivelli A, Zimmerhackl LB, Goodship T, Loirat C, (2013) Terminal complement inhibitor eculizumab in atypical hemolytic-uremic syndrome. N Engl J Med 368: 2169-2181
15. Souweine B, Van der Linden T, Dupic L, Soufir L, Meyer P, (2011) Prise en charge des thrombopénies en réanimation (pathologies gravidiques exclues). Recommandations formalisées d’experts sous l’égide de la Société de réanimation de langue française (SRLF), avec la participation du Groupe francophone de réanimation et urgences pédiatriques (GFRUP) et du Groupe d’étude hémostase thrombose (GEHT) de la Société française d’hématologie (SFH). Réanimation 20: 264-270
Liens utiles
Centre National de Référence des MAT
http://cnr-mat.fr/
Centre National de Référence des Escherichia coli, Shigella et Salmonella
http://www.pasteur.fr/ip/easysite/pasteur/fr/sante/centres-nationaux-de-reference-et-centres-collaborateurs-de-l-oms/cnr-et-ccoms/cnr-des-escherichia-coli–shigella-et-salmonella/identite-et-coordonnees


