Dr Antoine MONSEL
Réanimation Chirurgicale Polyvalente (Pr LANGERON)
Département d’Anesthésie – Réanimation Chirurgicale (Pr PUYBASSET)
Hôpital Universitaire Pitié-Salpêtrière – Charles Foix, Paris 6
Tél: +33(0)1.84.82.73.99 – Fax: +33(0)1.42.17.58.79
Sorbonne Universités, Université Pierre et Marie Curie
INSERM – UMR S 959 – Immunologie-Immunopathologie-Immunothérapie (i3)
Parce qu’ils sont pris en charge dans les suites immédiates de chirurgies majeures et/ou qu’ils présentent plusieurs défaillances d’organes vitaux, les patients admis en réanimation médico-chirurgicale ou chirurgicale sont dans la grande majorité des cas, intubés et ventilés artificiellement. Les pneumonies qu’ils développent, qu’elles soient post-opératoires ou non, possèdent une physiopathologie commune et spécifique générée par de multiples facteurs d’agression inflammatoire pulmonaire inhérents à leur prise en charge en réanimation. La mise en place d’une sonde d’intubation endotrachéale indispensable à la protection des voies aériennes et à l’administration d’une ventilation artificielle, génère notamment une série de mécanismes physiopathologiques centrés sur les micro-inhalations des sécrétions oropharyngées vers les voies aériennes distales. Dans un certain nombre de cas, l’infection pulmonaire qui en résulte présente des caractéristiques uniques en termes de présentation clinique, d’histopathologie, de facteurs de risque et de morbi-mortalité.
Définitions, incidences
Les pneumonies nosocomiales ou pneumonies acquises à l’hôpital sont fréquentes et représentent la deuxième cause d’infection nosocomiale (American Thoracic and Infectious Diseases Society of 2005). Elles se définissent par le fait qu’elles n’étaient ni présentes, ni en cours d’incubation lors de l’admission du patient à l’hôpital, avec un délai minimum de 48 heures séparant l’admission du début de l’infection. La survenue d’une pneumonie nosocomiale dans les suites d’une chirurgie définit une sous-catégorie spécifique de pneumonie nosocomiale : la pneumonie nosocomiale post-opératoire (PNPO). Les pneumonies acquises sous ventilation mécanique (PAVM) constituent un autre sous-groupe des pneumonies nosocomiales survenant spécifiquement chez les sujets ventilés depuis au moins 48h. La limite de 5 jours de ventilation mécanique est classiquement acceptée pour différentier les PAVM précoces des PAVM tardives (Langer, et al. 1987). Les pneumonies nosocomiales rencontrées en réanimation sont donc de deux types :
-les PNPO (incluant les PAVM post-opératoires)
-les PAVM (à distance ou en dehors de toute chirurgie)
Les PNPO, globalement moins étudiées que les PAVM, touchent pourtant 1,3% (Delgado-Rodriguez, et al. 1997, Martin, et al. 1984) à 17,5% (Garibaldi, et al. 1981) des patients toutes chirurgies confondues et 20% des patients en post-opératoire de chirurgie vasculaire majeure, avec une augmentation importante après 48 heures de ventilation mécanique. Une incidence de 40% a été décrite en post-opératoire de chirurgie thoracique. La grande variabilité des incidences recueillies dans la littérature s’explique par la difficulté de l’établissement du diagnostic de PNPO dans le contexte inflammatoire de réanimation, l’hétérogénéité des critères diagnostiques utilisés, les différents types de chirurgie ainsi que l’hétérogénéité des populations étudiées (Shander, et al. 2011). L’étude épidémiologique française EOLE menée dans 150 centres (Montravers, et al. 2002), a par exemple montré que sur la totalité des patients ayant présenté un épisode de PNPO, 31% étaient diagnostiqués de façon certaine, et 47% de façon probable. L’incidence des PAVM varie largement d’un service de réanimation à un autre en fonction principalement de la stratégie diagnostique employée et de la population étudiée. Les densités d’incidence des PAVM retrouvées dans la littérature varient de 1 à 20 cas, avec une moyenne de 7 cas pour 1000 jours de ventilation mécanique (Hubmayr, et al. 2002). L’incidence des PAVM représente quant à elle 8 à 28% des patients sous ventilation mécanique, 10 à 20% des patients ventilés depuis plus de 48 heures, ce qui en fait la principale complication infectieuse nosocomiale en réanimation (Chastre and Fagon 2002, Shander, et al. 2011). Cette incidence est maximale et estimée à 3%/jour pendant les 5 premiers jours de ventilation mécanique, puis diminue à 2%/jour du cinquième au dixième jour, pour arriver à 1%/ jour au-delà du dixième jour (Cook, et al. 1998).
Morbi-mortalité, impacts économiques
Les PNPO majorent la durée d’hospitalisation de 7 à 9 jours, et entrainent dans les études américaines un surcout estimé de 40 000 U.S. dollars par patient et par épisode (American Thoracic and Infectious Diseases Society of 2005, Cook, et al. 1998). La mortalité associée aux PNPO varient dans les études de 15 à 45% (Dupont, et al. 2003, Ghaferi, et al. 2009, Sabate, et al. 2014, Shander, et al. 2011). Ghaferi et al, ont par exemple retrouvé une mortalité associée entre 16,5 et 25,5% majorée jusqu’à 31% en cas de ventilation mécanique associée (Ghaferi, et al. 2009). Dans l’étude EOLE (Montravers, et al. 2002), la mortalité globale était de l’ordre de 20% mais la mortalité attribuable aux PNPO était de 5 à 7%. Toutes les PNPO ne nécessitent pas l’hospitalisation en réanimation (19 à 33% dans l’étude EOLE), néanmoins lorsque celle-ci s’impose, cette complication se grève d’une mortalité associée plus élevée, se rapprochant de celle rencontrée dans les PAVM (Dupont, et al. 2003). Dans cette même étude, malgré la précocité de survenue de la pneumopathie, la proportion de germes nosocomiaux était élevée. Shander et al (Shander, et al. 2011) ont d’ailleurs montré que les micro-organismes isolés dans les PNPO étaient identiques à ceux des PAVM avec une prédominance de germes type Streptococcus spp, Staphylococcus spp et Haemophilus influenzae dans les infections précoces et une prédominance de bacilles gram négatif et de micro-organismes multi résistants type Pseudomonas spp et Staphylocoque aureus méticilline résistants dans les infections plus tardives. En réanimation, elles imposent la mise en route d’une antibiothérapie probabiliste et jouent un rôle dans la pression de sélection microbiologique (Bergmans, et al. 1997, Kollef 2005, Singh, et al. 1998).
En ce qui concerne les PAVM, La plupart des études (études multivariées de cohorte ou de type cas-témoins) établissent leur mortalité imputable de 0% à 50%, les risques ratio de mortalité attribuable variant de 1 à 23,2 (American Thoracic and Infectious Diseases Society of 2005, Chastre 2008, Hubmayr, et al. 2002, Safdar, et al. 2005). La récente méta-analyse de Melsen et al. établie une moralité imputable globale à 13% (Melsen, et al. 2013). Les PAVM sont responsables d’une augmentation de la durée de ventilation mécanique de 10 jours, de la durée de séjour en réanimation de 4 à 18 jours et de la durée d’hospitalisation de 11 jours (Hubmayr, et al. 2002, Rello, et al. 2002, Safdar, et al. 2005). Par conséquent, elles représentent un surcoût économique global important évalué entre 5000 et 14000 U.S. dollars par patient et par épisode (Cook, et al. 1998, Rello, et al. 2002). Les PAVM motivent jusqu’à 50% des prescriptions d’antibiotiques en réanimation (American Thoracic and Infectious Diseases Society of 2005, Barbut and Coignard 2006, Chastre 2008). Leurs répercussions sur le pronostic des patients sont d’autant plus sévères que la PAVM est tardive (Kollef, et al. 1995).
Facteurs de risque
Les facteurs de risque associés aux PNPO se divisent en facteurs liés aux patients et ceux liés à l’intervention chirurgicale (Dupont, et al. 2003, Fujita and Sakurai 1995, Garibaldi, et al. 1981, Montravers, et al. 2002, Smetana, et al. 2006).
Les facteurs de risque liés aux patients sont principalement :
- l’âge supérieur à 65 ans
- le score ASA supérieur à II
- le tabagisme actif
- les antécédents de bronchopathie chronique obstructive (BPCO)
- les antécédents de diabète
- les antécédents d’insuffisance cardiaque
Les facteurs liés à la chirurgie concernent (Fujita and Sakurai 1995, Garibaldi, et al. 1981):
- le type de procédure chirurgicale
- la voie d’abord
- la durée d’intervention
- le saignement peropératoire
- la transfusion massive
De nombreuses études multivariées ont pu établir un certain nombre de facteurs de risques indépendants de PAVM. Ils sont représentés dans le Tableau 1. Dans le cadre de la pneumonie nosocomiale, l’intubation endotrachéale, commune aux PNPO et PAVM, constitue à elle seule un facteur de risque indépendant de pneumonie avec des risques relatifs allant de 7 à 21 (Levine and Niederman 1991).
| Facteurs de risque liés aux patients | Facteurs de risque liés à la réanimation |
| Hypoalbuminémie | Anti H2 ± anti-acides |
| Âge > 60 ans | Curarisation, sédation intraveineuse continue |
| SDRA | Transfusion > 4 unités |
| BPCO | Monitorage de la pression intracrânienne |
| Coma ou troubles de la conscience | Ventilation mécanique > 2 jours |
| Brûlure, traumatismes graves | PEEP |
| Défaillance d’organe | Changements fréquents des circuits du respirateur |
| Sévérité de la pathologie préexistante | Réintubation |
| Inhalations importantes | Sonde nasogastrique |
| Colonisation gastrique | Décubitus dorsal |
| Colonisation trachéo-bronchique | Transport |
| Sinusite | Antibiothérapie préalable |
Tableau ‑1: Principaux facteurs de risque de survenue de PAVM. SDRA = Syndrome respiratoire aigu de l’adulte, BPCO = Bronchopathie chronique obstructive, PEEP = Pression expiratoire positive. D’après (Chastre and Fagon 2002)
Physiopathologie
La physiopathologie des PNPO est similaire à celle des PAVM (Shander, et al. 2011). Elle repose essentiellement sur la transcolonisation des réservoirs oro-naso-pharyngés, et gastriques convergeant vers la région sous-glottiques, et sur les micro-inhalations répétées des sécrétions oropharyngées contaminées vers les voies respiratoires distales. Les agents pathogènes retrouvés dans les PNPO sont semblables à ceux mis en évidence dans les PAVM.
Sonde d’intubation endotrachéale
Toute intervention chirurgicale longue impose la mise en place d’une sonde d’intubation endotrachéale (intubation endotrachéale) afin d’initier la ventilation mécanique et de protéger les voies aériennes au cours de l’anesthésie générale. A elle seule, la sonde d’intubation endotrachéale multiplie de 6 à 20 le risque de développer une pneumonie nosocomiale, suggérant son rôle prépondérant dans la physiopathogénie des PNPO et PAVM (Levine and Niederman 1991, Pneumatikos, et al. 2009, Ramirez, et al. 2007). Certains auteurs parlent même de « pneumonie liée à la sonde d’intubation endotrachéale » (Pneumatikos, et al. 2009).
Voie extraluminale : rôle des micro-inhalations
Les micro-inhalations correspondent à la progression lente de sécrétions accumulées en amont du ballonnet trachéal vers les voies respiratoires inférieures, dont la manifestation clinique est la pneumopathie. Les sécrétions peuvent prendre leur source à partir des réservoirs bactériens oropharyngés, naso-sinusiens et gastriques. Dès les premières heures de ventilation mécanique, plusieurs études ont décrit un phénomène de transcolonisation de ces 3 réservoirs, phénomène dynamique dans le temps et l’espace, aboutissant à une modification profonde quantitative et qualitative de la flore bactérienne commensale (Estes and Meduri 1995, Feldman, et al. 1999, Niederman 1990, Safdar, et al. 2005). La flore commensale oropharyngée habituellement constituée d’une majorité de streptocoques viridans, de Streptococcus pneumoniae, d’Haemophilus spp, de Neisseria spp et d’anaérobies (Bacteroïdes, Fusobacterium, Veilonella) se voit remplacée par des bacilles aérobies Gram-négatifs, des Staphylococcus aureus, et de Pseudomonas aeruginosa (Esparza, et al. 2001, Niederman 1990, Safdar, et al. 2005, Young, et al. 2006). Le deuxième réservoir à se coloniser est l’estomac. En effet, la flore commensale gastrique du sujet sain reste habituellement réduite et pauvre, dû aux conditions extrêmes d’acidité. Chez le patient ventilé mécaniquement, sous influence de multiples facteurs pharmacologiques et instrumentaux, cette flore s’enrichit surtout en entérobactéries (Esparza, et al. 2001, Safdar, et al. 2005). Un autre réservoir potentiel représenté par les sinus, voit sa flore commensale (constituée de streptocoques viridans, de Streptococcus pneumoniae, d’Haemophilus spp, de Neisseria spp) remplacée par des bacilles Gram-négatifs aérobies avec une majorité d’entérobactéries mais également des Pseudomonas spp. et Acinetobacter spp (Estes and Meduri 1995, Metheny, et al. 2002). Enfin, l’arbre trachéobronchique qui constitue le dernier réservoir habituellement stérile pouvant ensemencer les vois aériennes distales, se trouve, lui aussi, colonisé par des bacilles Gram-négatifs aérobies, Pseudomonas spp et Acinetobacter spp dès les premiers jours de ventilation mécanique (Young, et al. 2006). Les facteurs initiant la transcolonisation des réservoirs sont liés à la fois aux modifications de l’hôte (inflammation et dysimmunité) et aux soins (prothèses, antibiotiques, sédation, anti-acides) inhérents au contexte de chirurgie majeure (Figure 1).
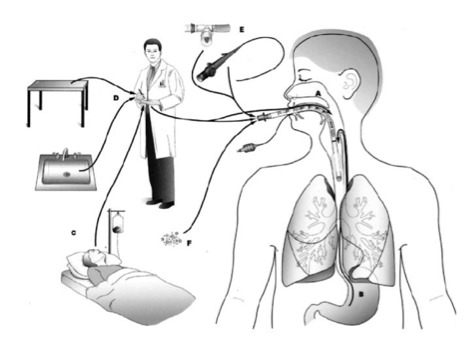
Figure‑1: Origines de la flore colonisatrice des réservoirs bactériens à l’origine des PAVM. A : réservoir oropharyngé et nasosinusien. B : réservoir gastrique. C : transmission croisée entre les patients. D : transmission croisée manuportée par les soignants à partir de germes de l’environnement. E : germes apportés par le matériel intervenant dans la ventilation ou les procédures invasives. F : inoculation directe de germes de l’environnement à travers la sonde d’IET.
Chez un patient porteur d’une sonde d’intubation endotrachéale, ces trois réservoirs alimentent les sécrétions sous glottiques qui s’accumulent en amont du ballonnet majoritairement au niveau de la zone déclive (Figures 2 et 3). Le volume accumulé est variable (de 2 à 18 ml dans l’étude de Greene, (Greene, et al. 1994)) et cette stase de sécrétions peut contenir jusqu’à 1010 Unités Formant Colonie (UFC) /ml (figure 3). Le ballonnet étant la seule barrière entre l’oropharynx et les voies aériennes inférieures, son étanchéité a un rôle prépondérant dans les phénomènes de micro-inhalation et la survenue des PNPO et PAVM.
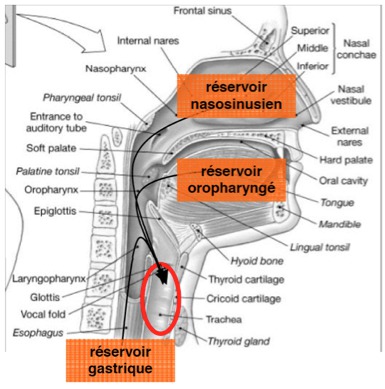
Figure‑2: Coupe sagittale du carrefour aérodigestif supérieur montrant la convergence des différents réservoirs bactériens vers la région sous-glottique.
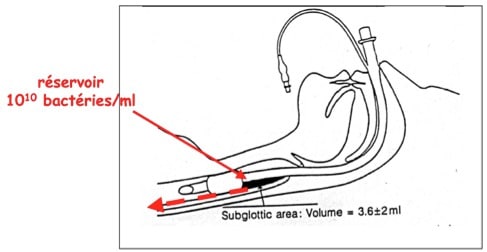
Figure 3: Coupe schématique sagittale montrant l’accumulation des sécrétions sous-glottiques (flèche noire) provenant des différents réservoirs bactériens préalablement trans-colonisés. D’après (Greene, et al. 1994).
En pratique clinique, la survenue de micro-inhalations reste difficile à évaluer et le diagnostic de pneumopathie permet sa confirmation a posteriori. Néanmoins, en recherche clinique, plusieurs méthodes de détection des micro-inhalations, non utilisables en routine, ont été décrites.
Malgré ces difficultés méthodologiques, les études montrent que même dans le cas d’un ballonnet correctement gonflé, des fuites des sécrétions accumulées en amont du ballonnet surviennent de manière fréquente (Metheny, et al. 2006, Pavlin, et al. 1975, Seegobin and van Hasselt 1986, Young, et al. 2006, Young, et al. 1997). L’inhalation des sécrétions sous-glottiques survient chez 20 à 40 % des patients intubés avec des sondes à ballonnet basse pression-haut volume (BPHV), et peut atteindre 77 % chez les patients intubés plus de 3 jours (Elpern, et al. 1987, Spray, et al. 1976). Ces micro-inhalations répétées sont dues à des défauts de compliance du matériau des ballonnets ou aux mouvements relatifs de la sonde d’intubation endotrachéale induits par la ventilation ou les soins. Le lien de causalité entre l’accumulation des sécrétions sous-glottiques, la colonisation des voies aériennes distales et l’incidence des PAVM a été bien établi dans plusieurs études (Craven and Steger 1995, Mahul, et al. 1992, Smulders, et al. 2002, Torres, et al. 1992, Valles, et al. 1995). Sa responsabilité dans la voie de contamination des voies aériennes distales est prépondérante.
Voie endoluminale: rôle du biofilm bactérien
La voie endoluminale s’explique par l’inoculation directement à travers la sonde d’intubation endotrachéale de germes vers les voies aériennes distales. La sonde peut en effet se comporter comme une simple voie de passage de germes de l’environnement apportés de manière iatrogène par les soins. La manipulation des différentes pièces du circuit respiratoire, les systèmes d’humidification et les aspirations trachéales peuvent en effet être à l’origine d’inoculations de germes directement manuportés (Craven and Steger 1995, Rello, et al. 1996). D’autre part, la lumière de la sonde d’intubation endotrachéale constitue une surface propice à la colonisation, par le développement de systèmes tels que les biofilms. D’ailleurs, des concordances entre bactéries du biofilm et celles retrouvées dans le parenchyme pulmonaire ont déjà été établies par plusieurs auteurs (Adair, et al. 1999, Bo, et al. 2000, Chen, et al. 2007, Corley, et al. 1997, Feldman, et al. 1999). Les biofilms ont donc potentiellement un rôle dans l’initiation mais également dans la récidive et la pérennisation des PAVM (American Thoracic and Infectious Diseases Society of 2005). Enfin, parmi les autres mécanismes physiopathologiques de genèse des PAVM, on peut également citer la voie de dissémination hématogène ou celle par contiguïté avec un autre foyer infectieux, même si elles restent clairement minoritaires (Estes and Meduri 1995).
Diagnostic
Principes diagnostiques
Si la définition épidémiologique de la PAVM reste consensuelle, il n’en n’est pas de même en ce qui concerne son approche diagnostique. Dans les années 1990, des classifications histologiques des processus infectieux parenchymateux pulmonaires ont été établies à partir de prélèvements histologiques post mortem (tableau 2) (Rouby, et al. 1992). Ainsi l’approche histologique a pu être employée en tant que méthode de référence dans plusieurs études. Cependant, Corley et al suggèrent l’absence de critères histologiques consensuels, le diagnostic de pneumonie variant de 18% à 38% d’un groupe de 39 patients en fonction de l’anatomo-pathologiste (Corley, et al. 1997). D’autre part, certaines lésions histologiques décrites ne sont pas spécifiques de processus infectieux pulmonaires, un certain nombre de biais persistent sur la technique de prélèvement histologique, et enfin, il est devenu de plus en plus difficile d’utiliser ces méthodes histologiques de manière systématique pour des raisons principalement éthiques.

Tableau‑2 : Classification histologique de J.J. Rouby et al. D’après (Rouby, et al. 1992).
Actuellement, le diagnostic de PAVM repose sur trois axes :
- les signes clinico-biologiques de syndrome infectieux
- les signes radiologiques nouveaux ou évolutifs récents d’infiltrats pulmonaires
- la mise en évidence microbiologique d’infection du parenchyme pulmonaire
Stratégie non invasive, dite « clinique »
Les signes clinico-biologiques classiquement décrits, à savoir, la fièvre, l’hyperleucocytose, la tachycardie, la bronchorrhée purulente, l’hypoxémie, ne sont en aucun cas spécifiques d’un état septique, encore moins d’une PAVM. En effet ils peuvent également traduire un état inflammatoire systémique ou « SIRS » relatif à toute affection grave d’origine infectieuse ou non.
Quant aux signes radiologiques, ils gardent une faible spécificité à eux seuls, expliquée par les diagnostics différentiels nombreux devant des opacités pulmonaires chez un patient ventilé en réanimation. Par conséquent, les critères clinico-biologiques ou radiologiques employés isolément ne permettent en aucun cas de diagnostiquer une PAVM de manière satisfaisante.
La combinaison de critères clinico-radiologiques permet d’améliorer la sensibilité et la spécificité de la méthode diagnostique, tout en gardant des taux importants de faux négatifs et faux positifs avoisinant les 30 % (Fagon, et al. 1993, Torres, et al. 1994). En revanche, l’ajout d’un critère microbiologique aux critères radio cliniques permet d’obtenir une bonne corrélation avec une technique bactériologique telle que le lavage broncho-alvéolaire (LBA). C’est le principe du Clinical Pulmonary Infection Score (CPIS) décrit en 1991, coté de 0 à 12 points, qui associe la température, le nombre de leucocytes, l’aspect des sécrétions trachéo-bronchiques, le rapport PaO2/FiO2, la radiographie pulmonaire, l’examen direct des secrétions et leur culture semi-quantitative (tableau 3).

Tableau‑3 : Clinical Pulmonary Infection Score. Un score >6 est prédictif de la présence d’une PAVM avec une sensibilité de 93% et une spécificité de 100% en comparaison avec le LBA (Pugin, et al. 1991). PAVM = pneumonie acquise sous ventilation mécanique, LBA = lavage broncho-alvéolaire.
Un score CPIS haut (supérieure à 6) serait corrélé à la présence de bactéries au lavage broncho-alvéolaire avec une sensibilité estimée à 93% et spécificité à 100% (Pugin, et al. 1991). Sa sensibilité est de 72% et sa spécificité de 85% lorsqu’il est comparé au diagnostic histologique de PAVM (Papazian, et al. 1995). La principale limite de cette stratégie dite « clinique » (figure 4) réside dans l’importance de la surestimation de l’incidence des PAVM. En effet, la colonisation trachéo-bronchique combinée à des images radiologiques d’infiltrats et à un tableau clinico-biologique de sepsis est fréquente en l’absence de réelle pneumonie bactérienne et conduit à l’utilisation inappropriée d’antibiotiques. Cependant, cette stratégie diagnostique ne semble pas modifier le pronostic des patients comme le suggère le résultat d’une large étude multicentrique canadienne (2006).
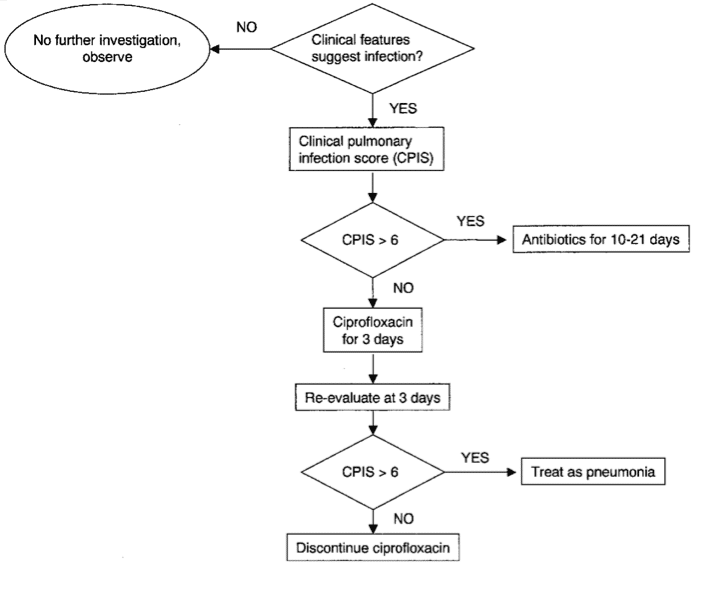
Figure‑4: Algorithme diagnostique de gestion d’une suspicion de PAVM basée sur une stratégie Clinique (ATS = American Thoracic Society). D’après (Chastre and Fagon 2002).
Stratégie clinico-microbiologique
Ainsi, l’emploi d’une méthode microbiologique quantitative paraît essentiel, tant sur le plan de la performance diagnostique que sur le plan de la documentation bactériologique, permettant d’orienter et donc de restreindre le spectre d’une antibiothérapie probabiliste débutée initialement de manière empirique. L’impact de cette réduction de spectre sur l’écologie bactérienne à l’échelle de l’individu et de la communauté reste majeur, et doit constituer un objectif quotidiennement recherché par tout clinicien. En terme de technique de documentation microbiologique quantitative, 3 possibilités s’offrent au praticien :
- l’aspiration trachéale
- le prélèvement distal fibro-guidé
- le prélèvement distal non fibro-guidé, dit « à l’aveugle »
Finalement si la nécessité d’associer aux signes radio-cliniques un prélèvement quantitatif des sécrétions pulmonaires semble clairement établie, la technique d’obtention de ces sécrétions n’est pas univoque. Le choix se fait en fonction des possibilités techniques et matérielles de chaque service, et des caractéristiques de chaque patient. L’algorithme résumant la stratégie invasive diagnostique de PAVM est représenté par la figure 5.
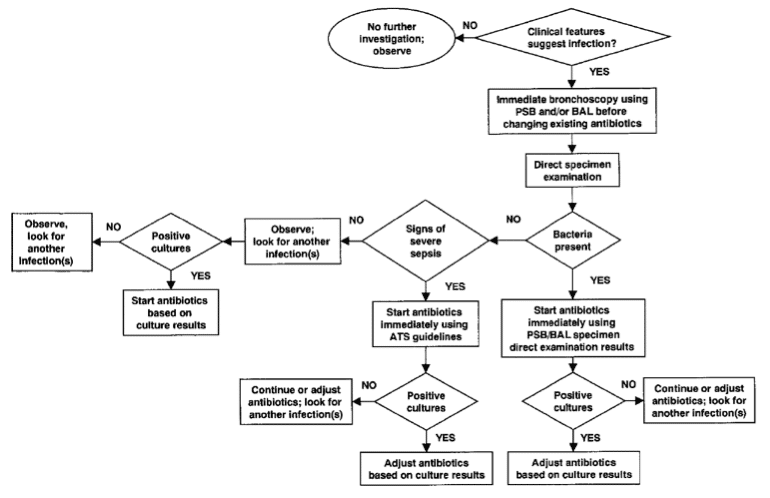
Figure‑5: Algorithme diagnostique de gestion d’une suspicion de PAVM basée sur une stratégie invasive. D’après (Chastre and Fagon 2002).
Prévention
Le ballonnet de la sonde d’intubation endotrachéale
Le phénomène de micro-inhalation n’est rendu possible, par définition, que par la faillite du ballonnet de la sonde d’intubation endotrachéale à assurer l’étanchéité des voies aériennes vis-à-vis des sécrétions sous-glottiques. En effet, le passage des sécrétions sous glottiques survient en raison de la congruence imparfaite entre le ballonnet et la trachée. Trois facteurs au niveau du ballonnet sont susceptibles d’altérer son étanchéité : la pression, le matériau et la forme.
La pression d’insufflation du ballonnet optimale recommandée est comprise entre 20 et 30 cmH2O. En dehors de ces valeurs, le ballonnet est sous-gonflé et facilite les macro-inhalations, ou sur-gonflé et peut entraîner des lésions ischémiques de la muqueuse trachéale (American Thoracic and Infectious Diseases Society of 2005, Brichet, et al. 1999, Brichet, et al. 1999, Kastanos, et al. 1983, Rello, et al. 1996, Seegobin and van Hasselt 1984). Habituellement, lorsqu’un patient est mis sous ventilation mécanique, la pression du ballonnet est réglée entre 20 et 30 cmH2O puis contrôlée toutes les 3-8 heures selon les services (pas de recommandations en terme de fréquence de contrôle de la pression du ballonnet).
Même lorsque la pression d’insufflation du ballonnet est optimisée, la conception actuelle des ballonnets (design, forme et matériau) génère un excès de matériel comparativement au diamètre trachéal, ce qui provoque la formation de nervures ou micro-sillons (figure 6) responsables de micro-inhalations (Metheny, et al. 2006, Pavlin, et al. 1975, Pneumatikos, et al. 2009, Ramirez, et al. 2007, Young, et al. 1997).
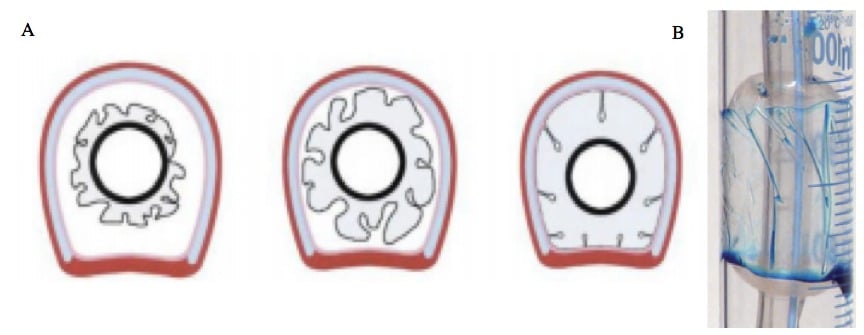
Figure ‑6: A, image transversale de la trachée représentant schématiquement les microsillons formés à la surface d’un ballonnet non gonflé à gauche, peu gonflé au milieu et gonflé normalement à droite ; B, Photographie d’un ballonnet montrant des microsillons responsables du passage du bleu de méthylène de la surface proximale vers la surface distale du ballonnet (modèle in vitro).
Le type de matériau utilisé pour le ballonnet permet de réduire le nombre de microsillons à des niveaux de pressions satisfaisants (Dullenkopf, et al. 2003). Plus le matériau est fin, moins il existe de microsillons. C’est le cas des ballonnets en PU dont l’épaisseur de la paroi est de 7 à 10 µm, soit 10 fois inférieure à celle des ballonnets en PVC. Cependant, devant les limites méthodologiques de ces dernières études et compte tenu du coût élevé de production de ce matériau, le développement des sondes à ballonnets en PU a été freiné. Par conséquence, malgré une disponibilité commerciale, leur usage en pratique courante reste réduit.
La forme du ballonnet des sondes d’intubation endotrachéale est aussi impliquée dans la genèse des microsillons décrits plus haut, et donc, dans son étanchéité. En considérant que la congruence parfaite entre le ballonnet et la trachée n’est pas possible avec un ballonnet de diamètre transversal constant sur toute sa hauteur, des ballonnets de forme conique ont été mis au point. Récemment, une étude rétrospective (Bowton, et al. 2013) et une autre prospective (Philippart, et al. 2015) n’ont pas retrouvé d’effet bénéfique de la forme conique des ballonnets en PVC sur l’incidence des PAVM pour la première, ni des colonisation trachéo-bronchiques pour la seconde.
Drainage des sécrétions sous-glottiques
Le développement du concept de drainage des sécrétions sous-glottiques, né d’une compréhension de la physiopathogénèse prépondérante de la PAVM, n’a été possible qu’à partir de la disponibilité d’une sonde d’IET modifiée rendant possible ce type de drainage. Ainsi, en 1992, la sonde d’IET Hi-Lo Evac tube® (TYCO Healthcare/Mallinckrodt, St Louis, Missouri, distribué par Nellcor Puritan Benett, Inc, Pleasanton, Californie) est commercialisée ; une lumière indépendante dorsale permet le drainage des sécrétions accumulées dans l’espace sous-glottique, à partir d’une ouverture elliptique située juste au-dessus du ballonnet. De 1992 à 2008, ont été réalisées 6 études monocentriques contrôlées randomisées étudiant l’impact de l’aspiration des sécrétions sous-glottiques en exploitant la sonde Hi-Lo Evac®. Le groupe traité est donc constitué de patients intubés par la sonde Hi-Lo Evac® avec aspirations sous-glottiques, continues ou discontinues, et le groupe contrôle de patients intubés soit par une sonde d’IET classique, soit par la sonde Hi-Lo Evac® sans aspirations sous-glottiques. Trois de ces études ont été réalisées en réanimation médico-chirurgicale polyvalente (Mahul, et al. 1992, Smulders, et al. 2002, Valles, et al. 1995), 2 en réanimation de chirurgie cardiaque (Bouza, et al. 2008, Kollef, et al. 1999) et une en réanimation chirurgicale (Bo, et al. 2000). Certaines de ces études suggèrent un effet favorable de l’aspiration des sécrétions sous-glottiques dans la prévention de la PAVM, même si d’autres restent négatives. C’est donc dans ce contexte que la méta-analyse de Dezfulian et al a été publiée, en 2005 (Dezfulian, et al. 2005). Elle inclue 5 des 6 études présentées plus haut (Bouza, et al. 2008, Kollef, et al. 1999, Mahul, et al. 1992, Smulders, et al. 2002, Valles, et al. 1995), soit 896 patients. L’étude de Bouza et al ayant été publiée en 2008, n’a pas pu faire partie de cette méta-analyse. Comme décrit plus haut, les 5 études emploient des critères diagnostiques de PAVM différents, et de nombreux facteurs de risque de PAVM ne sont pas colligés, ou sont gérés différemment. C’est le cas de la prophylaxie anti-ulcéreuse, du positionnement ou de l’usage préalable d’antibiotiques. Néanmoins, une réduction du risque de PAVM de 50% (RR = 0,51 ; IC95% [0,37-0,71]) est observée dans le groupe avec aspirations des sécrétions sous-glottiques, ce qui correspond à une diminution globale de l’incidence de PAVM de 57%. Dans une analyse complémentaire ne prenant en compte que les 4 études réalisées en réanimation médico-chirurgicale ou chirurgicale et incluant des patients avec une durée de VM prévue supérieure à 48 ou 72 heures, l’aspiration des sécrétions sous-glottiques réduit le risque de développer une PAVM de 50% (RR = 0,50 ; IC = [0,35-0,71]), de 2 jours la durée de ventilation mécanique, de 3 jours la durée de séjour en réanimation et retarde de 6,8 jours la survenue de la PAVM. Ainsi les auteurs de cette méta-analyse concluent à l’efficacité de l’aspiration sous-glottique dans la prévention des PAVM précoces chez les patients intubés et ventilés plus de 72 heures, avec des répercussions bénéfiques en terme de durée de ventilation mécanique et de durée de séjour en réanimation.
C’est dans ce contexte qu’une étude multicentrique randomisée contrôlée a été menée en France (Lacherade, et al. 2010). Incluant 333 patients, elle démontre que le drainage des sécrétions sous-glottiques était associé à une réduction absolue de la survenue de PAVM de 10,8% (IC95% [2,3%-19,4%]). La probabilité de ne pas développer de PAVM durant la durée de ventilation mécanique était significativement supérieure dans le groupe avec drainage sous-glottique comparé au groupe contrôle (test de log-rank, 9,55 ; p = 0,002). Aucune différence en termes de dyspnée laryngée post-extubation n’était observée entre les deux groupes. La méta-analyse qui suit en 2011 confirme un effet favorable du drainage des sécrétions sous-glottiques sur l’incidence des PAVM, la durée de séjour en réanimation et la durée de ventilation mécanique (Muscedere, et al. 2011). A partir de 2008, la plupart des recommandations internationales ont intégré l’aspiration sous-glottique au sein de l’arsenal des modalités préventives des PAVM. D’autres études restent à réaliser afin de déterminer quelles sont les modalités optimales de fonctionnement de ce dispositif (aspiration manuelle ou automatisée, niveau de dépression à adopter, rythme des drainages à réaliser, conduite à tenir en cas d’occlusion du canal d’aspiration).
Sondes imprégnées
L’étude des biofilms a permis de concevoir la sonde d’intubation endotrachéale comme un véritable réservoir bactérien capable de régulièrement ensemencer la trachée, les bronches et le parenchyme pulmonaire. Malgré de nombreux arguments qui établissent un lien entre les bactéries du biofilm de la sonde d’intubation endotrachéale et celles retrouvées au sein du parenchyme pulmonaire infecté, il reste difficile d’établir un lien de causalité entre ces deux phénomènes. Le biofilm est-il à l’origine des PAVM ou est-il simplement le témoin d’une colonisation des voies aériennes du patient intubé-ventilé en réanimation ? Deux axes ont été explorés pour essayer de répondre à cette question : le premier consiste à éviter la formation du biofilm au sein de la sonde d’intubation endotrachéale, le deuxième consiste en l’élimination du biofilm déjà formé.
L’ensemble de cet argumentaire a conduit à la réalisation de la première étude prospective randomisée, contrôlée, menée dans 54 centres Nord-Américains, incluant 2003 patients pour déterminer l’impact des sondes imprégnées d’Argent sur l’incidence des PAVM microbiologiquement confirmées (Kollef, et al. 2008). La seule différence entre les deux groupes était l’imprégnation d’Argent de la sonde d’intubation endotrachéale utilisée pour intuber les patients du groupe traité. Le diagnostic de PAVM était posé si les critères cliniques étaient confirmés par l’analyse microbiologique d’un prélèvement pulmonaire distal. L’incidence des PAVM était de 4,8% dans le groupe intubé avec la sonde imprégnée, et de 7,5% dans le groupe intubé par une sonde standard (p = 0,03), soit une réduction de risque relatif de 35,9% et un nombre de patients à intuber avec la sonde imprégnée pour éviter un épisode de PAVM de 37 (IC95 = [19-369]). Le délai de survenue des PAVM était augmenté dans le groupe traité. Aucune différence en terme de durée de ventilation mécanique, de durée de séjour en réanimation, de durée d’hospitalisation ou de mortalité n’était retrouvée. Aucune différence n’était non plus constatée en terme d’incidence et de sévérité des complications liées à l’intubation endotrachéale. Cependant, Il semble important de nuancer ces résultats devant certaines limites de l’étude. D’abord, la faible incidence globale des PAVM limite la généralisation des résultats suggérés. Cette faible incidence est due d’une part à l’impossibilité d’inclure les patients intubés en urgence, ces derniers étant incapables de donner un consentement éclairé (critère d’inclusion dans l’étude) et d’autre part, à une durée médiane de ventilation mécanique de 4 jours, témoin d’un niveau de gravité intermédiaire des patients inclus. Par ailleurs, la proportion plus importante de patients présentant une bronchite chronique obstructive (BPCO), facteur de risque connu de PAVM, dans le groupe contrôle (16,4% versus 11,6%, p = 0,007) peut avoir influé sur les incidences observées. D’autre part, dans une lettre à l’auteur, Michael Klompas attire notre attention sur le fait que 30% des prélèvements distaux pulmonaires ont mis en évidence une flore polymorphe commensale, colonisant habituellement l’arbre trachéo-bronchique (Klompas 2008). En recalculant les incidences de PAVM dans les deux groupes en ne comptabilisant que les germes pathogènes, la différence n’est alors plus significative. Enfin, dans un éditorial faisant suite à l’étude de Kollef et al, Jean Chastre souligne le biais négatif représenté par l’introduction d’une antibiothérapie faisant suite à la suspicion clinique de PAVM et précédant le prélèvement pulmonaire (Chastre 2008). Ceci a pu concourir à la diminution de l’incidence des PAVM. De plus, il évoque que l’efficacité préventive de la sonde d’intubation endotrachéale imprégnée n’est démontrée que pour les PAVM précoces, interdisant toute conclusion sur son usage chez les patients ventilés plus de 7 jours. Autrement dit, l’efficacité de cette technique n’est pas encore démontrée pour prévenir les PAVM tardives, celles qui pourtant génèrent le plus de morbi-mortalité. De plus, il n’est pas certain que la différence entre les deux groupes persiste si une stratégie préventive multifactorielle avait été appliquée dans les deux groupes. Jean Chastre conclut à la restriction de l’emploi de ce type de sonde d’intubation endotrachéale aux seuls patients à haut risque de développer une PAVM dont l’incidence reste anormalement élevée malgré une politique de stratégie préventive multifactorielle.
En ce qui concerne l’exploitation de l’axe préventif visant à éliminer le biofilm déjà formé sur les parois de la sonde d’intubation endotrachéale, l’équipe de Kolobow et al a développé une sonde d’aspiration trachéale conçue pour éliminer le plus de sécrétions muqueuses intraluminales possible (Kolobow, et al. 2006). Ce système, testé chez le mouton, démontre sa faisabilité et son efficacité dans l’élimination du biofilm bactérien. Il semble apporter un avantage en terme d’accumulation de mucus et de colonisation de la sonde d’intubation endotrachéale dans une étude animale chez 12 moutons intubés 72 heures (Berra, et al. 2006). Aucune donnée clinique pertinente ne permet cependant d’encourager l’emploi de ce type de matériel. Chez l’homme, son innocuité et son efficacité en terme de prévention des PAVM ne sont pas démontrées.
Trachéotomie précoce
En raison du rôle central de la sonde d’intubation endotrachéale dans la physiopathogénèse de la PAVM, il est licite de se poser la question de la possibilité de s’en affranchir, en exploitant une autre voie d’abord permettant de prolonger la ventilation mécanique chez les patients requérant une ventilation invasive prolongée. La problématique de la trachéotomie précoce se pose alors. Dans le cadre de la ventilation de longue durée, la trachéotomie présente plusieurs avantages : amélioration du confort des patients, de l’accès pour les soins oropharyngés, de la gestion des aspirations trachéales, de la communication avec les patient, possibilité d’une alimentation orale, diminution des résistances des voies aériennes supérieures et de l’espace mort instrumental et réduction des lésions laryngées induites par la sonde d’intubation endotrachéale (Pneumatikos, et al. 2009). En revanche, la réalisation d’une trachéotomie reste une technique invasive avec des complications possibles (Heffner, et al. 1986). Les indications et le moment de sa réalisation doivent donc faire l’objet d’une réflexion globale de gestion du bénéfice-risque. L’impact de la trachéotomie précoce, c’est-à-dire dans les 7 premiers jours de ventilation invasive, sur l’incidence des PAVM reste controversé. Dans la méta-analyse de Griffiths et al de 2005 (Griffiths, et al. 2005), qui regroupe 406 patients de 5 études différentes, la trachéotomie précoce ne diminue ni le risque de survenue de pneumonie nosocomiale, ni la mortalité hospitalière. En revanche, elle réduit significativement la durée de ventilation mécanique (diminution moyenne de 8,5 jours ; IC95% = [1,7-15,3]) et la durée de séjour en réanimation (différence moyenne de -15,3 jours ; IC95% = [6,1-24,6]). Les principales limitations de cette méta-analyse sont le faible nombre d’études disponibles sur le sujet, une hétérogénéité significative des différentes études principalement expliquée par des critères d’inclusion et d’exclusion différents, et une définition du délai de réalisation de la trachéotomie précoce qui diffère en fonction de l’étude. De plus ces 5 études se sont intéressées à des patients de réanimation spécialisée présentant des pathologies spécifiques. D’autres études doivent être menées pour clarifier le délai de réalisation de la trachéotomie précoce et son impact sur l’incidence des PAVM. Actuellement, aucune recommandation ne peut être formulée sur l’encouragement de cette pratique par manque de données cliniques suffisantes.
Autres moyens de prévention
En dehors de la sonde d’intubation et de ces éventuelles modifications, d’autres éléments interviennent dans la genèse des PAVM. Une synthèse des principaux moyens de prévention des PAVM est représentée par le tableau 5 à partir des recommandations éditées par différentes sociétés savantes.
De plus, de manière plus intéressante, une dizaine d’études ont mesuré l’impact de l’application de stratégies globales associant plusieurs moyens préventifs, et ont pu ainsi montrer une réduction de 30 à 60% de l’incidence des PAVM (Coffin, et al. 2008, Gastmeier and Geffers 2007). Ces études encouragent chaque service de réanimation à adopter une telle démarche de mise en place de sensibilisation et d’évaluation du respect d’une stratégie globale regroupant différents moyens de prévention, afin d’espérer pouvoir réduire localement l’incidence des PAVM, et donc, la morbi-mortalité et le surcoût qu’elles entraînent.
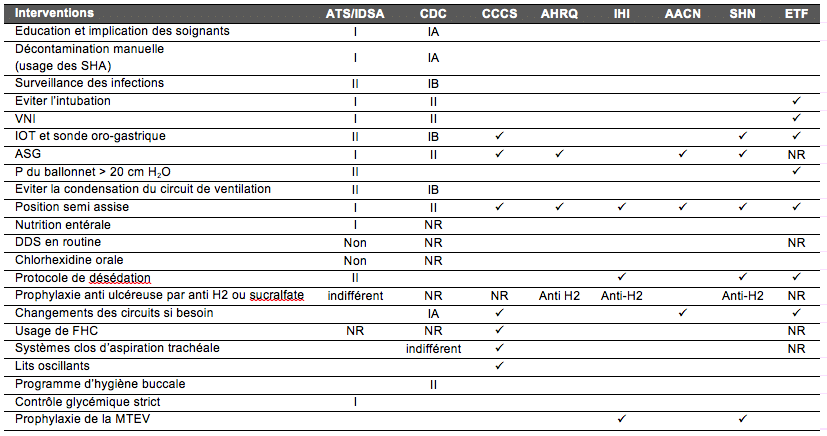
Tableau‑5: Synthèse des recommandations d’usage des moyens de prévention des PAVM étudiés dans la littérature médicale. NR : non résolue. ü : intervention incluse dans les recommandations pratiques de la société savante. ATS : American Thoracic Society. IDSA : Infectious Disease Society of America. CDC = Centers for Disease Control, CCCS = Canadian Critical Care Society, AHRQ = Agency for Healthcare Research and Quality, IHI = Institute for Healthcare Improvement, AACN = American Association of Critical Care Nurses, SHN = Safer Healthcare Now, SHA = solutions hydro-alcooliques.
Références
A randomized trial of diagnostic techniques for ventilator-associated pneumonia. N Engl J Med 2006; 355:2619-30.
Adair CG, Gorman SP, Feron BM, Byers LM, Jones DS, Goldsmith CE, Moore JE, Kerr JR, Curran MD, Hogg G, Webb CH, McCarthy GJ, Milligan KR. Implications of endotracheal tube biofilm for ventilator-associated pneumonia. Intensive Care Med 1999; 25:1072-6.
American Thoracic S, Infectious Diseases Society of A. Guidelines for the management of adults with hospital-acquired, ventilator-associated, and healthcare-associated pneumonia. Am J Respir Crit Care Med 2005; 171:388-416.
Barbut F, Coignard B. [Nosocomial infections]. Rev Prat 2006; 56:2065-71.
Barquist ES, Amortegui J, Hallal A, Giannotti G, Whinney R, Alzamel H, MacLeod J. Tracheostomy in ventilator dependent trauma patients: a prospective, randomized intention-to-treat study. J Trauma 2006; 60:91-7.
Bergmans DC, Bonten MJ, Gaillard CA, van Tiel FH, van der Geest S, de Leeuw PW, Stobberingh EE. Indications for antibiotic use in ICU patients: a one-year prospective surveillance. J Antimicrob Chemother 1997; 39:527-35.
Berra L, Curto F, Li Bassi G, Laquerriere P, Baccarelli A, Kolobow T. Antibacterial-coated tracheal tubes cleaned with the Mucus Shaver : a novel method to retain long-term bactericidal activity of coated tracheal tubes. Intensive Care Med 2006; 32:888-93.
Berra L, De Marchi L, Yu ZX, Laquerriere P, Baccarelli A, Kolobow T. Endotracheal tubes coated with antiseptics decrease bacterial colonization of the ventilator circuits, lungs, and endotracheal tube. Anesthesiology 2004; 100:1446-56.
Berra L, Kolobow T, Laquerriere P, Pitts B, Bramati S, Pohlmann J, Marelli C, Panzeri M, Brambillasca P, Villa F, Baccarelli A, Bouthors S, Stelfox HT, Bigatello LM, Moss J, Pesenti A. Internally coated endotracheal tubes with silver sulfadiazine in polyurethane to prevent bacterial colonization: a clinical trial. Intensive Care Med 2008; 34:1030-7.
Bo H, He L, Qu J. [Influence of the subglottic secretion drainage on the morbidity of ventilator associated pneumonia in mechanically ventilated patients]. Zhonghua Jie He He Hu Xi Za Zhi 2000; 23:472-4.
Bo H, He L, Qu J. [Observation of biofilms inside tracheal tubes by electron microscopy and the relationship between biofilms and VAP]. Zhonghua Jie He He Hu Xi Za Zhi 2000; 23:300-2.
Borderon E, Leprince A, Gueveler C, Borderon JC. [The diagnostic value of quantitative bacteriology in tracheal aspirates compared to lung biopsy (author’s transl)]. Rev Fr Mal Respir 1981; 9:229-39.
Bouderka MA, Fakhir B, Bouaggad A, Hmamouchi B, Hamoudi D, Harti A. Early tracheostomy versus prolonged endotracheal intubation in severe head injury. J Trauma 2004; 57:251-4.
Bouza E, Perez MJ, Munoz P, Rincon C, Barrio JM, Hortal J. Continuous aspiration of subglottic secretions in the prevention of ventilator-associated pneumonia in the postoperative period of major heart surgery. Chest 2008; 134:938-46.
Bowton DL, Hite RD, Martin RS, Sherertz R. The impact of hospital-wide use of a tapered-cuff endotracheal tube on the incidence of ventilator-associated pneumonia. Respir Care 2013; 58:1582-7.
Brichet A, Verkindre C, Dupont J, Carlier ML, Darras J, Wurtz A, Ramon P, Marquette CH. Multidisciplinary approach to management of postintubation tracheal stenoses. Eur Respir J 1999; 13:888-93.
Brichet A, Verkindre C, Ramon P, Marquette CH. [Post-intubation tracheal stenosis]. Rev Mal Respir 1999; 16:685-92.
Brook AD, Sherman G, Malen J, Kollef MH. Early versus late tracheostomy in patients who require prolonged mechanical ventilation. Am J Crit Care 2000; 9:352-9.
Cai S, Zhang J, Qian G. [Correlation of endotracheal tube biofilm and recurrent ventilator-associated pneumonia with Pseudomonas aeruginosa]. Zhonghua Jie He He Hu Xi Za Zhi 2001; 24:339-41.
Chaiban G, Hanna H, Dvorak T, Raad I. A rapid method of impregnating endotracheal tubes and urinary catheters with gendine: a novel antiseptic agent. J Antimicrob Chemother 2005; 55:51-6.
Chastre J. Preventing ventilator-associated pneumonia: could silver-coated endotracheal tubes be the answer? JAMA 2008; 300:842-4.
Chastre J, Fagon JY. Ventilator-associated pneumonia. Am J Respir Crit Care Med 2002; 165:867-903.
Chen BM, Yu JL, Liu GX, Hu LY, Li LQ, Li F, Yang H. [Electron microscopic analysis of biofilm on tracheal tubes removed from intubated neonates and the relationship between bilofilm and lower respiratory infection]. Zhonghua Er Ke Za Zhi 2007; 45:655-60.
Coffin SE, Klompas M, Classen D, Arias KM, Podgorny K, Anderson DJ, Burstin H, Calfee DP, Dubberke ER, Fraser V, Gerding DN, Griffin FA, Gross P, Kaye KS, Lo E, Marschall J, Mermel LA, Nicolle L, Pegues DA, Perl TM, Saint S, Salgado CD, Weinstein RA, Wise R, Yokoe DS. Strategies to prevent ventilator-associated pneumonia in acute care hospitals. Infect Control Hosp Epidemiol 2008; 29 Suppl 1:S31-40.
Cook DJ, Walter SD, Cook RJ, Griffith LE, Guyatt GH, Leasa D, Jaeschke RZ, Brun-Buisson C. Incidence of and risk factors for ventilator-associated pneumonia in critically ill patients. Ann Intern Med 1998; 129:433-40.
Corley DE, Kirtland SH, Winterbauer RH, Hammar SP, Dail DH, Bauermeister DE, Bolen JW. Reproducibility of the histologic diagnosis of pneumonia among a panel of four pathologists: analysis of a gold standard. Chest 1997; 112:458-65.
Costerton JW, Stewart PS, Greenberg EP. Bacterial biofilms: a common cause of persistent infections. Science 1999; 284:1318-22.
Craven DE, Steger KA. Epidemiology of nosocomial pneumonia. New perspectives on an old disease. Chest 1995; 108:1S-16S.
D’Haese J, De Keukeleire T, Remory I, Van Rompaey K, Umbrain V, Poelaert J. Assessment of intraoperative microaspiration: does a modified cuff shape improve sealing? Acta Anaesthesiol Scand 2013; 57:873-80.
Dave MH, Frotzler A, Spielmann N, Madjdpour C, Weiss M. Effect of tracheal tube cuff shape on fluid leakage across the cuff: an in vitro study. Br J Anaesth 2010; 105:538-43.
Delgado-Rodriguez M, Medina-Cuadros M, Martinez-Gallego G, Sillero-Arenas M. Usefulness of intrinsic surgical wound infection risk indices as predictors of postoperative pneumonia risk. J Hosp Infect 1997; 35:269-76.
Depew CL, McCarthy MS. Subglottic secretion drainage: a literature review. AACN Adv Crit Care 2007; 18:366-79.
Dezfulian C, Shojania K, Collard HR, Kim HM, Matthay MA, Saint S. Subglottic secretion drainage for preventing ventilator-associated pneumonia: a meta-analysis. Am J Med 2005; 118:11-8.
Donlan RM. Biofilm formation: a clinically relevant microbiological process. Clin Infect Dis 2001; 33:1387-92.
Donlan RM. Biofilms and device-associated infections. Emerg Infect Dis 2001; 7:277-81.
Donlan RM, Costerton JW. Biofilms: survival mechanisms of clinically relevant microorganisms. Clin Microbiol Rev 2002; 15:167-93.
Dullenkopf A, Gerber A, Weiss M. Fluid leakage past tracheal tube cuffs: evaluation of the new Microcuff endotracheal tube. Intensive Care Med 2003; 29:1849-53.
Dunham CM, LaMonica C. Prolonged tracheal intubation in the trauma patient. J Trauma 1984; 24:120-4.
Dupont H, Montravers P, Gauzit R, Veber B, Pouriat JL, Martin C, Club d’Infectiologie en A-R. Outcome of postoperative pneumonia in the Eole study. Intensive Care Med 2003; 29:179-88.
Elpern EH, Jacobs ER, Bone RC. Incidence of aspiration in tracheally intubated adults. Heart Lung 1987; 16:527-31.
Esparza J, Boivin MA, Hartshorne MF, Levy H. Equal aspiration rates in gastrically and transpylorically fed critically ill patients. Intensive Care Med 2001; 27:660-4.
Estes RJ, Meduri GU. The pathogenesis of ventilator-associated pneumonia: I. Mechanisms of bacterial transcolonization and airway inoculation. Intensive Care Med 1995; 21:365-83.
Fagon JY, Chastre J, Hance AJ, Domart Y, Trouillet JL, Gibert C. Evaluation of clinical judgment in the identification and treatment of nosocomial pneumonia in ventilated patients. Chest 1993; 103:547-53.
Feldman C, Kassel M, Cantrell J, Kaka S, Morar R, Goolam Mahomed A, Philips JI. The presence and sequence of endotracheal tube colonization in patients undergoing mechanical ventilation. Eur Respir J 1999; 13:546-51.
Filloux B, Bedel A, Nseir S, Mathiaux J, Amadeo B, Clouzeau B, Pillot J, Saghi T, Vargas F, Hilbert G, Gruson D, Boyer A. Tracheal amylase dosage as a marker for microaspiration: a pilot study. Minerva Anestesiol 2013; 79:1003-10.
Fujita T, Sakurai K. Multivariate analysis of risk factors for postoperative pneumonia. Am J Surg 1995; 169:304-7.
Garibaldi RA, Britt MR, Coleman ML, Reading JC, Pace NL. Risk factors for postoperative pneumonia. Am J Med 1981; 70:677-80.
Gastmeier P, Geffers C. Prevention of ventilator-associated pneumonia: analysis of studies published since 2004. J Hosp Infect 2007; 67:1-8.
Ghaferi AA, Birkmeyer JD, Dimick JB. Variation in hospital mortality associated with inpatient surgery. N Engl J Med 2009; 361:1368-75.
Gilbert P, McBain AJ. Biofilms: their impact on health and their recalcitrance toward biocides. Am J Infect Control 2001; 29:252-5.
Girou E, Buu-Hoi A, Stephan F, Novara A, Gutmann L, Safar M, Fagon JY. Airway colonisation in long-term mechanically ventilated patients. Effect of semi-recumbent position and continuous subglottic suctioning. Intensive Care Med 2004; 30:225-33.
Greene R, Thompson S, Jantsch HS, Teplick R, Cullen DJ, Greene EM, Whitman GJ, Hulka CA, Llewellyn HJ. Detection of pooled secretions above endotracheal-tube cuffs: value of plain radiographs in sheep cadavers and patients. AJR Am J Roentgenol 1994; 163:1333-7.
Griffiths J, Barber VS, Morgan L, Young JD. Systematic review and meta-analysis of studies of the timing of tracheostomy in adult patients undergoing artificial ventilation. Bmj 2005; 330:1243.
Heffner JE, Miller KS, Sahn SA. Tracheostomy in the intensive care unit. Part 1: Indications, technique, management. Chest 1986; 90:269-74.
Hubmayr RD, Burchardi H, Elliot M, Fessler H, Georgopoulos D, Jubran A, Limper A, Pesenti A, Rubenfeld G, Stewart T, Villar J, American Thoracic Society Assembly on Critical C, European Respiratory S, European Society of Intensive Care M, Societe de Reanimation de Langue F. Statement of the 4th International Consensus Conference in Critical Care on ICU-Acquired Pneumonia–Chicago, Illinois, May 2002. Intensive Care Med 2002; 28:1521-36.
Inglis TJ, Jones JG, Paxton S. Penetration of an aerosol, produced by film atomization, through the carinal bifurcation. Br J Anaesth 1993; 70:527-31.
Inglis TJ, Millar MR, Jones JG, Robinson DA. Tracheal tube biofilm as a source of bacterial colonization of the lung. J Clin Microbiol 1989; 27:2014-8.
Kastanos N, Estopa Miro R, Marin Perez A, Xaubet Mir A, Agusti-Vidal A. Laryngotracheal injury due to endotracheal intubation: incidence, evolution, and predisposing factors. A prospective long-term study. Crit Care Med 1983; 11:362-7.
Klompas M. Silver-coated endotracheal tubes and patient outcomes in ventilator-associated pneumonia. Jama 2008; 300:2605; author reply 05-6.
Koerner RJ. Contribution of endotracheal tubes to the pathogenesis of ventilator-associated pneumonia. J Hosp Infect 1997; 35:83-9.
Kollef MH. What is ventilator-associated pneumonia and why is it important? Respir Care 2005; 50:714-21; discussion 21-4.
Kollef MH, Afessa B, Anzueto A, Veremakis C, Kerr KM, Margolis BD, Craven DE, Roberts PR, Arroliga AC, Hubmayr RD, Restrepo MI, Auger WR, Schinner R. Silver-coated endotracheal tubes and incidence of ventilator-associated pneumonia: the NASCENT randomized trial. Jama 2008; 300:805-13.
Kollef MH, Silver P, Murphy DM, Trovillion E. The effect of late-onset ventilator-associated pneumonia in determining patient mortality. Chest 1995; 108:1655-62.
Kollef MH, Skubas NJ, Sundt TM. A randomized clinical trial of continuous aspiration of subglottic secretions in cardiac surgery patients. Chest 1999; 116:1339-46.
Kolobow T, Li Bassi G, Curto F, Zanella A. The Mucus Slurper: A novel tracheal tube that requires no tracheal tube suctioning. A preliminary report. Intensive Care Med 2006; 32:1414-8.
Lacherade JC, De Jonghe B, Guezennec P, Debbat K, Hayon J, Monsel A, Fangio P, Appere de Vecchi C, Ramaut C, Outin H, Bastuji-Garin S. Intermittent subglottic secretion drainage and ventilator-associated pneumonia: a multicenter trial. Am J Respir Crit Care Med 2010; 182:910-7.
Langer M, Cigada M, Mandelli M, Mosconi P, Tognoni G. Early onset pneumonia: a multicenter study in intensive care units. Intensive Care Med 1987; 13:342-6.
Lesnik I, Rappaport W, Fulginiti J, Witzke D. The role of early tracheostomy in blunt, multiple organ trauma. Am Surg 1992; 58:346-9.
Levine SA, Niederman MS. The impact of tracheal intubation on host defenses and risks for nosocomial pneumonia. Clin Chest Med 1991; 12:523-43.
Lichtenthal PR, Maul D, Borg U. Do tracheal tubes prevent microaspiration? Br J Anaesth 2011; 107:821-2.
Lucangelo U, Zin WA, Antonaglia V, Petrucci L, Viviani M, Buscema G, Borelli M, Berlot G. Effect of positive expiratory pressure and type of tracheal cuff on the incidence of aspiration in mechanically ventilated patients in an intensive care unit. Crit Care Med 2008; 36:409-13.
Luna CM, Vujacich P, Niederman MS, Vay C, Gherardi C, Matera J, Jolly EC. Impact of BAL data on the therapy and outcome of ventilator-associated pneumonia. Chest 1997; 111:676-85.
Madjdpour C, Mauch J, Dave MH, Spielmann N, Weiss M. Comparison of air-sealing characteristics of tapered- vs. cylindrical-shaped high-volume, low-pressure tube cuffs. Acta Anaesthesiol Scand 2012; 56:230-5.
Mahul P, Auboyer C, Jospe R, Ros A, Guerin C, el Khouri Z, Galliez M, Dumont A, Gaudin O. Prevention of nosocomial pneumonia in intubated patients: respective role of mechanical subglottic secretions drainage and stress ulcer prophylaxis. Intensive Care Med 1992; 18:20-5.
Martin LF, Asher EF, Casey JM, Fry DE. Postoperative pneumonia. Determinants of mortality. Arch Surg 1984; 119:379-83.
Meert KL, Daphtary KM, Metheny NA. Detection of pepsin and glucose in tracheal secretions as indicators of aspiration in mechanically ventilated children. Pediatr Crit Care Med 2002; 3:19-22.
Melsen WG, Rovers MM, Groenwold RH, Bergmans DC, Camus C, Bauer TT, Hanisch EW, Klarin B, Koeman M, Krueger WA, Lacherade JC, Lorente L, Memish ZA, Morrow LE, Nardi G, van Nieuwenhoven CA, O’Keefe GE, Nakos G, Scannapieco FA, Seguin P, Staudinger T, Topeli A, Ferrer M, Bonten MJ. Attributable mortality of ventilator-associated pneumonia: a meta-analysis of individual patient data from randomised prevention studies. Lancet Infect Dis 2013; 13:665-71.
Metheny NA, Clouse RE, Chang YH, Stewart BJ, Oliver DA, Kollef MH. Tracheobronchial aspiration of gastric contents in critically ill tube-fed patients: frequency, outcomes, and risk factors. Crit Care Med 2006; 34:1007-15.
Metheny NA, Dahms TE, Chang YH, Stewart BJ, Frank PA, Clouse RE. Detection of pepsin in tracheal secretions after forced small-volume aspirations of gastric juice. JPEN J Parenter Enteral Nutr 2004; 28:79-84.
Metheny NA, Dahms TE, Stewart BJ, Stone KS, Edwards SJ, Defer JE, Clouse RE. Efficacy of dye-stained enteral formula in detecting pulmonary aspiration. Chest 2002; 122:276-81.
Montravers P, Veber B, Auboyer C, Dupont H, Gauzit R, Korinek AM, Malledant Y, Martin C, Moine P, Pourriat JL. Diagnostic and therapeutic management of nosocomial pneumonia in surgical patients: results of the Eole study. Crit Care Med 2002; 30:368-75.
Mulier JP, Van den Brande F, Dillemans B, Van Cauwenberge s. Tracheal cuff leak in morbid obese patients intubated with a Taperguard, a Hi-Lo cuffed or a Hi-Lo cuffed and lubrificated tracheal tube. PGA New York 2009:9108.
Muscedere J, Rewa O, McKechnie K, Jiang X, Laporta D, Heyland DK. Subglottic secretion drainage for the prevention of ventilator-associated pneumonia: a systematic review and meta-analysis. Crit Care Med 2011; 39:1985-91.
Niederman MS. Gram-negative colonization of the respiratory tract: pathogenesis and clinical consequences. Semin Respir Infect 1990; 5:173-84.
Nseir S, Brisson H, Marquette CH, Chaud P, Di Pompeo C, Diarra M, Durocher A. Variations in endotracheal cuff pressure in intubated critically ill patients: prevalence and risk factors. Eur J Anaesthesiol 2009; 26:229-34.
Nseir S, Zerimech F, De Jonckheere J, Alves I, Balduyck M, Durocher A. Impact of polyurethane on variations in tracheal cuff pressure in critically ill patients: a prospective observational study. Intensive Care Med 2010; 36:1156-63.
Olson ME, Harmon BG, Kollef MH. Silver-coated endotracheal tubes associated with reduced bacterial burden in the lungs of mechanically ventilated dogs. Chest 2002; 121:863-70.
Orhan-Sungur M, Akca O. Antiseptic impregnated endotracheal tubes, biofilms, and ventilator-associated pneumonia. Crit Care Med 2006; 34:2855-7.
Pacheco-Fowler V, Gaonkar T, Wyer PC, Modak S. Antiseptic impregnated endotracheal tubes for the prevention of bacterial colonization. J Hosp Infect 2004; 57:170-4.
Papazian L, Thomas P, Garbe L, Guignon I, Thirion X, Charrel J, Bollet C, Fuentes P, Gouin F. Bronchoscopic or blind sampling techniques for the diagnosis of ventilator-associated pneumonia. Am J Respir Crit Care Med 1995; 152:1982-91.
Pavlin EG, VanNimwegan D, Hornbein TF. Failure of a high-compliance low-pressure cuff to prevent aspiration. Anesthesiology 1975; 42:216-9.
Philippart F, Gaudry S, Quinquis L, Lau N, Ouanes I, Touati S, Nguyen JC, Branger C, Faibis F, Mastouri M, Forceville X, Abroug F, Ricard JD, Grabar S, Misset B, Group TO-CS. Randomized intubation with polyurethane or conical cuffs to prevent pneumonia in ventilated patients. Am J Respir Crit Care Med 2015; 191:637-45.
Pneumatikos IA, Dragoumanis CK, Bouros DE. Ventilator-associated pneumonia or endotracheal tube-associated pneumonia? An approach to the pathogenesis and preventive strategies emphasizing the importance of endotracheal tube. Anesthesiology 2009; 110:673-80.
Prince AS. Biofilms, antimicrobial resistance, and airway infection. N Engl J Med 2002; 347:1110-1.
Pugin J, Auckenthaler R, Mili N, Janssens JP, Lew PD, Suter PM. Diagnosis of ventilator-associated pneumonia by bacteriologic analysis of bronchoscopic and nonbronchoscopic « blind » bronchoalveolar lavage fluid. Am Rev Respir Dis 1991; 143:1121-9.
Ramirez P, Ferrer M, Torres A. Prevention measures for ventilator-associated pneumonia: a new focus on the endotracheal tube. Curr Opin Infect Dis 2007; 20:190-7.
Rello J, Kollef M, Diaz E, Sandiumenge A, del Castillo Y, Corbella X, Zachskorn R. Reduced burden of bacterial airway colonization with a novel silver-coated endotracheal tube in a randomized multiple-center feasibility study. Crit Care Med 2006; 34:2766-72.
Rello J, Ollendorf DA, Oster G, Vera-Llonch M, Bellm L, Redman R, Kollef MH, Group VAPOSA. Epidemiology and outcomes of ventilator-associated pneumonia in a large US database. Chest 2002; 122:2115-21.
Rello J, Sonora R, Jubert P, Artigas A, Rue M, Valles J. Pneumonia in intubated patients: role of respiratory airway care. Am J Respir Crit Care Med 1996; 154:111-5.
Rezaiguia-Delclaux S, Streich B, Bouleau D, Delchier JC, Dhonneur G, Meignan M, Duvaldestin P. Pulmonary scintigraphy for diagnosis of aspiration during intravenous propofol anaesthesia for colonoscopy. Br J Anaesth 2001; 87:204-6.
Rodriguez JL, Steinberg SM, Luchetti FA, Gibbons KJ, Taheri PA, Flint LM. Early tracheostomy for primary airway management in the surgical critical care setting. Surgery 1990; 108:655-9.
Rouby JJ, Martin De Lassale E, Poete P, Nicolas MH, Bodin L, Jarlier V, Le Charpentier Y, Grosset J, Viars P. Nosocomial bronchopneumonia in the critically ill. Histologic and bacteriologic aspects. Am Rev Respir Dis 1992; 146:1059-66.
Rumbak MJ, Newton M, Truncale T, Schwartz SW, Adams JW, Hazard PB. A prospective, randomized, study comparing early percutaneous dilational tracheotomy to prolonged translaryngeal intubation (delayed tracheotomy) in critically ill medical patients. Crit Care Med 2004; 32:1689-94.
Sabate S, Mazo V, Canet J. Predicting postoperative pulmonary complications: implications for outcomes and costs. Curr Opin Anaesthesiol 2014; 27:201-9.
Safdar N, Crnich CJ, Maki DG. The pathogenesis of ventilator-associated pneumonia: its relevance to developing effective strategies for prevention. Respir Care 2005; 50:725-39; discussion 39-41.
Safdar N, Dezfulian C, Collard HR, Saint S. Clinical and economic consequences of ventilator-associated pneumonia: a systematic review. Crit Care Med 2005; 33:2184-93.
Saffle JR, Morris SE, Edelman L. Early tracheostomy does not improve outcome in burn patients. J Burn Care Rehabil 2002; 23:431-8.
Seegobin RD, van Hasselt GL. Endotracheal cuff pressure and tracheal mucosal blood flow: endoscopic study of effects of four large volume cuffs. Br Med J (Clin Res Ed) 1984; 288:965-8.
Seegobin RD, van Hasselt GL. Aspiration beyond endotracheal cuffs. Can Anaesth Soc J 1986; 33:273-9.
Shander A, Fleisher LA, Barie PS, Bigatello LM, Sladen RN, Watson CB. Clinical and economic burden of postoperative pulmonary complications: patient safety summit on definition, risk-reducing interventions, and preventive strategies. Crit Care Med 2011; 39:2163-72.
Singh N, Falestiny MN, Rogers P, Reed MJ, Pularski J, Norris R, Yu VL. Pulmonary infiltrates in the surgical ICU: prospective assessment of predictors of etiology and mortality. Chest 1998; 114:1129-36.
Smetana GW, Lawrence VA, Cornell JE, American College of P. Preoperative pulmonary risk stratification for noncardiothoracic surgery: systematic review for the American College of Physicians. Ann Intern Med 2006; 144:581-95.
Smulders K, van der Hoeven H, Weers-Pothoff I, Vandenbroucke-Grauls C. A randomized clinical trial of intermittent subglottic secretion drainage in patients receiving mechanical ventilation. Chest 2002; 121:858-62.
Sottile FD, Marrie TJ, Prough DS, Hobgood CD, Gower DJ, Webb LX, Costerton JW, Gristina AG. Nosocomial pulmonary infection: possible etiologic significance of bacterial adhesion to endotracheal tubes. Crit Care Med 1986; 14:265-70.
Spray SB, Zuidema GD, Cameron JL. Aspiration pneumonia; incidence of aspiration with endotracheal tubes. Am J Surg 1976; 131:701-3.
Stewart PS, Costerton JW. Antibiotic resistance of bacteria in biofilms. Lancet 2001; 358:135-8.
Sugerman HJ, Wolfe L, Pasquale MD, Rogers FB, O’Malley KF, Knudson M, DiNardo L, Gordon M, Schaffer S. Multicenter, randomized, prospective trial of early tracheostomy. J Trauma 1997; 43:741-7.
Torres A, el-Ebiary M, Padro L, Gonzalez J, de la Bellacasa JP, Ramirez J, Xaubet A, Ferrer M, Rodriguez-Roisin R. Validation of different techniques for the diagnosis of ventilator-associated pneumonia. Comparison with immediate postmortem pulmonary biopsy. Am J Respir Crit Care Med 1994; 149:324-31.
Torres A, Serra-Batlles J, Ros E, Piera C, Puig de la Bellacasa J, Cobos A, Lomena F, Rodriguez-Roisin R. Pulmonary aspiration of gastric contents in patients receiving mechanical ventilation: the effect of body position. Ann Intern Med 1992; 116:540-3.
Valles J. Monitoring intra-cuff pressure in subglottic aspiration. Crit Care Med 2005; 33:1469-70; author reply 70-1.
Valles J, Artigas A, Rello J, Bonsoms N, Fontanals D, Blanch L, Fernandez R, Baigorri F, Mestre J. Continuous aspiration of subglottic secretions in preventing ventilator-associated pneumonia. Ann Intern Med 1995; 122:179-86.
Wunderink RG, Woldenberg LS, Zeiss J, Day CM, Ciemins J, Lacher DA. The radiologic diagnosis of autopsy-proven ventilator-associated pneumonia. Chest 1992; 101:458-63.
Young PJ, Burchett K, Harvey I, Blunt MC. The prevention of pulmonary aspiration with control of tracheal wall pressure using a silicone cuff. Anaesth Intensive Care 2000; 28:660-5.
Young PJ, Pakeerathan S, Blunt MC, Subramanya S. A low-volume, low-pressure tracheal tube cuff reduces pulmonary aspiration. Crit Care Med 2006; 34:632-9.
Young PJ, Rollinson M, Downward G, Henderson S. Leakage of fluid past the tracheal tube cuff in a benchtop model. Br J Anaesth 1997; 78:557-62.
Zanella A, Scaravilli V, Isgro S, Milan M, Cressoni M, Patroniti N, Fumagalli R, Pesenti A. Fluid leakage across tracheal tube cuff, effect of different cuff material, shape, and positive expiratory pressure: a bench-top study. Intensive Care Med 2011; 37:343-7.


