Mis à jour le 15 juillet 2019
Contextes Professionnels
Version PDF
La mise à disposition d’emicizumab (Hemlibra® ; F. Hoffmann-La Roche, Bâle, Suisse) est récente et nécessite d’adapter les modalités de prise en charge en cas de saignement, de suspicion de saignement et lors de gestes invasifs réalisés en urgence ou programmée. Ceci impose la rédaction en concertation multidisciplinaire de propositions de prise en charge qui doivent régulièrement être adaptées aux données disponibles. Le texte suivant a été rédigé dans le but de guider la prise en charge des personnes atteintes d’hémophile A avec inhibiteur traitées par emicizumab en cas de saignement ou d’interventions invasives.
La méthodologie utilisée pour établir ces propositions a été la suivante : La filière pour les maladies hémorragiques constitutionnelles (MHEMO), le Centre français de référence en hémophilie (CRH), en collaboration avec le Groupe d’intérêt en hémostase périopératoire (GIHP), ont travaillé pour faire des propositions sur la gestion de ces situations. Trois auteurs représentant chaque groupe ont rédigé des propositions. Les différents groupes ont ensuite relu, discuté et modifié ces propositions. Les propositions s’appuient sur des données issues de la littérature et des expériences recueillies auprès des patients traités dans les centres de référence français (MHEMO).
Préambule
- emicizumab est un anticorps monoclonal bispécifique « mimant », ou plutôt reproduisant dans une certaine mesure, l’activité du FVIII1, et permettant de réduire les saignements spontanés chez l’hémophile A avec ou sans inhibiteur2,3. C’est un médicament dont l’usage est exclusivement prophylactique;
- emicizumab ne remplace pas le facteur VIII, dont il ne mime qu’imparfaitement l’activité coagulante. La protection conférée, bien que bonne, n’est donc que partielle, avec au mieux chez les malades traités un risque hémorragique équivalent à celui d’un hémophile mineur dont la concentration plasmatique de FVIII serait de l’ordre de 10% à 20%4,5;
- emicizumab est administré par injections sous-cutanées hebdomadaires à la dose de 1,5 mg/kg après une période de 4 semaines avec une dose hebdomadaire de charge de 3 mg/kg6,5;
- Sa demi-vie d’élimination est de 30 jours. La disparition complète des effets liés au médicament ne peut donc être obtenue en théorie qu’après 150 jours (soit 5 demi-vies)7,8;
- Aucune adaptation posologique n’est nécessaire hormis la prise en compte du poids (pas d’adaptation à l’âge, la fonction rénale ou hépatique) et la concentration du médicament est stable une fois la phase de plateau atteinte. Peu de cas d’immunisation contre ce médicament ont été rapportés mais la réapparition chez un patient d’accidents hémorragiques qui avaient disparu doit faire craindre l’apparition d’un anticorps anti-médicament (ADA)9;
- Les patients traités par emicizumab ont ex vivo un TCA normal et une génération de thrombine accrue. Le raccourcissement du TCA n’est pas dose-dépendant. Il n’y a pas de relation démontrée entre l’augmentation de la génération de thrombine sous emicizumab et l’efficacité clinique;
- En cas de saignements intercurrents, l’utilisation chez les patients traités par emicizumab de concentrés de complexe prothrombinique activé (CCPa) type FEIBA® à des doses supérieures à 100 U/kg pendant 24 heures ou plus a été associée à la survenue de micro-angiopathies thrombotiques (MAT) et d’accidents thrombotiques veineux9. Des études in vitro ont confirmé un effet synergique entre l’emicizumab et le CCPa10;
- Aucun cas de thrombose ou de MAT n’a été rapporté jusqu’à présent après administration isolée de rFVIIa, eptacog alfa, (NovoSeven®) sous emicizumab 11;
- Le recours au FEIBA® doit donc être réservé, sur avis du Centre de Ressources et de Compétences Maladies Hémorragiques Constitutionnelles, aux situations sans alternative ayant une efficacité thérapeutique équivalente, et dans ce cas seules des doses réduites seront prescrites;
- Afin de traiter d’éventuels accidents hémorragiques, les patients sous emicizumab ne doivent pas disposer à domicile (sauf cas très exceptionnels) de FEIBA® mais un accès en ambulatoire au rFVIIa (NovoSeven®) est possible;
- Certains patients sont considérés mauvais répondeurs au rFVIIa (NovoSeven®) ou aux concentrés de complexe prothrombinique activé (CCPa) FEIBA®12. Il a été proposé d’associer du rFVIIa (NovoSeven®) ou du CCPa (FEIBA®) à l’emicizumab selon la réponse biologique obtenue en génération de thrombine et selon la réponse antérieure du patient13. Il n’existe cependant pas de données suffisantes pour généraliser cette attitude. De plus, l’activité procoagulante d’emicizumab évaluée en génération de thrombine peut varier considérablement selon le réactif de déclenchement ou la composition en phospholipides 14.
Les patients atteints d’hémophilie A traités par emicizumab peuvent développer des manifestations hémorragiques aiguës, le plus souvent traumatiques, ou nécessiter une chirurgie en urgence ou une procédure invasive, pouvant nécessiter le recours à un traitement hémostatique complémentaire. Il n’y a en effet pas d’indication à effectuer des injections supplémentaires d’emicizumab dans ces situations. Ce médicament ne sera donc jamais utilisé dans un contexte d’urgence.
Prise en charge d’un accident hémorragique
Pour un patient traité par emicizumab, le traitement hémostatique complémentaire n’est pas systématique et dépendra de la nature et de la sévérité de l’accident hémorragique, des circonstances de survenue, la possibilité de le documenter par imagerie si nécessaire et des traitements symptomatiques envisageables de l’hémorragie (endoscopie, tamponnement, compression, chirurgie, embolisation…).
La concentration plasmatique d’emicizumab étant stable après le premier mois de traitement et la posologie n’ayant pas à être adaptée8, la date de la dernière injection d’emicizumab n’a a priori pas d’influence sur la couverture hémostatique du patient.
Contacter le Centre de Ressources et de Compétences Maladies Hémorragiques au sein duquel le patient est suivi. L’information est disponible sur la carte ou le carnet patient. Des contacts peuvent être trouvés sur le site MHEMO (https://mhemo.fr)
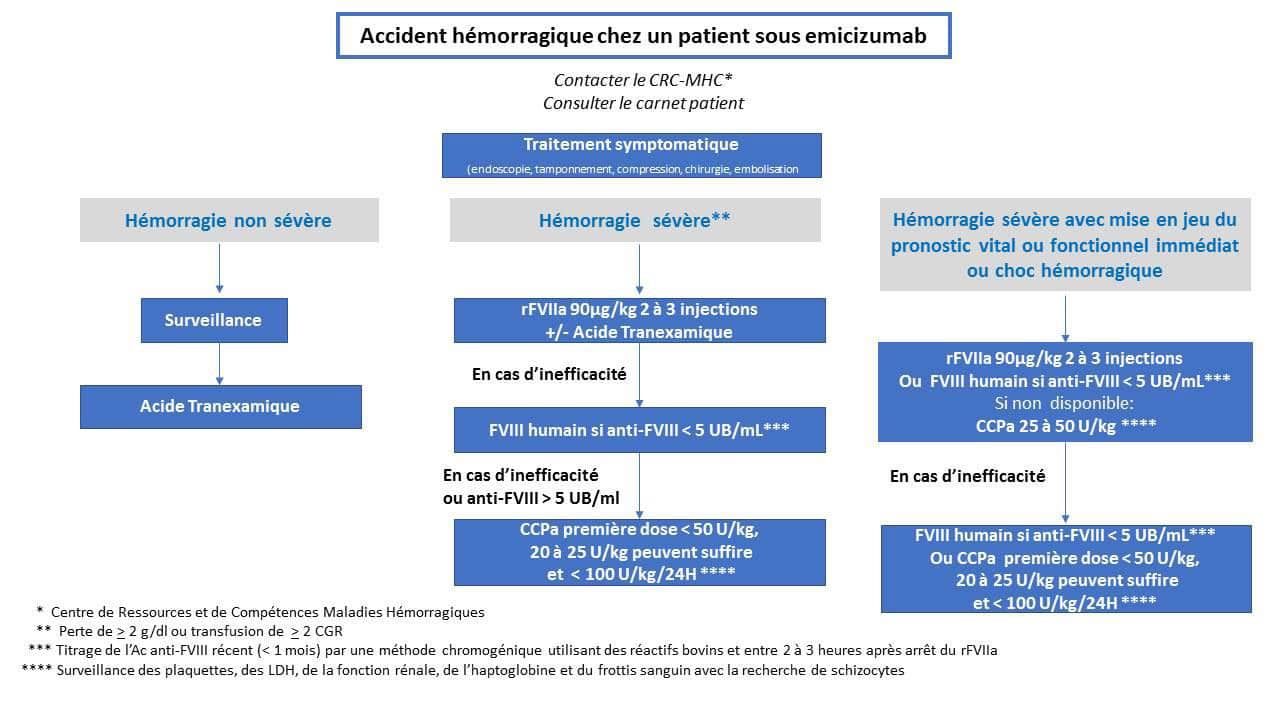
Le traitement et les médicaments prescrits seront définis selon la sévérité et le siège du saignement, selon la réponse hémostatique obtenue et en recherchant à garantir un rapport bénéfice/risque optimal, ils sont donc administrés par étapes. Ainsi, 3 niveaux de traitement peuvent être proposés (Figure 1).
1er niveau de traitement
Acide tranexamique
- En cas d’hémorragies muqueuses isolées un traitement par acide tranexamique seul aux posologies habituelles (2 à 4g/24h PO reparties en 3 ou 4 prises chez l’adulte et 20mg/kg sur 24h reparties en 3 ou 4 prises chez l’enfant à partir de 1 an) est proposé.
rFVIIa, eptacog alfa (activé) (NovoSeven®)
- Lors d’une hémorragie grave, telle que définie par les critères de l’ISTH15, c’est-à-dire mettant en jeu le pronostic vital ou touchant un organe critique, y compris les hémorragies articulaires et les hématomes musculaires importants, ou entraînant une chute du taux d’hémoglobine de 20 g L-1 ou plus, ou entraînant la transfusion de deux ou plus concentrés de globules rouges, la première ligne de traitement doit être le rFVIIa à une posologie de 90 µg/kg. Toutefois, certains auteurs ont proposé des doses plus faibles, comme 45 µg/kg, qui pourraient théoriquement être aussi efficaces, mais les données disponibles justifiant cette dose plus faible sont encore limitées.
L’acide tranexamique peut être combiné avec le rFVIIa. La première injection de rFVIIa peut se faire à domicile après avis médical du centre de traitement, éventuellement en collaboration avec l’équipe médicale d’urgence intervenant à domicile. Si des injections répétées sont susceptibles d’être nécessaires, l’admission à l’hôpital est nécessaire. La fréquence des injections et la durée du traitement par le rFVIIa doivent être adaptées à la gravité de la condition médicale. L’espacement des injections et/ou la diminution de la posologie doivent être envisagés dès que l’hémorragie est maîtrisée; - Il est à noter que le FVIII humain (FVIII dérivé du plasma ou recombinant) peut également être utilisé si le titre d’inhibiteur du FVIII, récemment (dosage au cours du mois précédent excluant la situation d’anamnèse possible due à d’autres perfusions de FVIII) mesuré par un dosage approprié (c’est-à-dire une méthode Bethesda chromogénique utilisant des réactifs bovins peu sensibles à l’emicizumab) est bas (< 5 BU/mL). Si le rFVIIa n'est pas disponible, ou si le FVIII humain ne peut pas être utilisé ou n'est pas disponible, le médicament de première intention devrait être l’CCPa avec une dose initiale de 20-25 U/kg.
2ème niveau de traitement
- Si le rFVIIa associé à l’acide tranexamique est inefficace (persistance des saignements malgré 3 injections à des intervalles de 2 ou 3 heures à une dose de 90 µg/kg), et si le titre de l’inhibiteur du FVIII est faible (< 5 UB/mL), on peut également envisager la perfusion de concentré de FVIII humain dans les 2 à 3 heures après la dernière administration du rFVIIa16. Cela souligne que le titrage des inhibiteurs, qui n'est pas effectué dans tous les centres, devrait faire partie du suivi de routine des patients avec inhibiteurs traités par emicizumab;
- La façon dont la présence associée d’emicizumab et de FVIII affecte l’hémostase chez les patients atteints d’hémophilie A demeure mal connue. Toutefois, étant donné l’efficacité respective d’emicizumab et du FVIII pour stimuler l’activité du FIXa 4, on peut émettre l’hypothèse que le FVIII injecté aura la même efficacité en présence ou en l’absence d’emicizumab;
- Dans le cas d’une hémorragie grave, la dose de FVIII nécessaire doit être calculée sur la base du titre d’inhibiteur (< 5 UB/mL) et afin de maintenir le FVIII au-dessus de 80 UI/dL au moins pendant les 48 premières heures. Pour maintenir cet objectif, il peut parfois être nécessaire d'augmenter la fréquence des injections en bolus, voire de passer à la perfusion continue17;
- Le suivi des concentrations plasmatiques de FVIII doit être réalisé à l’aide d’une méthode de dosage chromogénique avec emploi d’un réactif contenant des facteurs de coagulation bovins (pas d’interférence avec la présence d’emicizumab. Les dosages de FVIII par méthode chronométrique (ou tout autre test chronométrique basé sur le TCA) ou par méthode chromogénique utilisant des réactifs d’origine humaine sont ininterprétables sous emicizumab;
- Le FVIII porcin recombinant (Obizur®, susoctocog alpha, Baxalta US Inc, compagnie de Takeda, Lexington, MA, USA) n’est pas encore approuvé dans cette indication, cependant l’utilisation de ce médicament pourrait être envisagée en cas de saignement grave ne répondant pas aux agents de by-pass si le titre de l’anti-FVIII porcin est faible.
3ème niveau de traitement
- En cas d’inefficacité du rFVIIa (NovoSeven®) (persistance d’un saignement malgré 3 injections à 2 ou 3 heures d’intervalle à la posologie de 90 µg/kg), ou d’inefficacité du FVIII humain ou d’impossibilité d’utiliser le FVIII, après réévaluation de l’intérêt d’une embolisation, leCCPa peut être prescrit sous stricte surveillance médicale clinique et biologique, nécessitant impérativement une hospitalisation;
- La première dose de CCPa ne doit pas dépasser 50 U/kg, et une dose initiale de 20-25 U/kg peut être suffisante pour contrôler le saignement. En cas d’inefficacité, une deuxième dose de CCPa peut être proposée 12 heures plus tard, en veillant à ne jamais dépasser une dose maximale de 100 U/kg sur 24 heures. Compte tenu de l’action synergique des CCPa et de l’emicizumab, la dose de CCPa doit toujours être inférieure à celle utilisée dans l’hémophilie A avec inhibiteur sans prophylaxie par emicizumab;
- Comme mentionné dans le dernier point du paragraphe préambule, il a été suggéré que l’efficacité et l’innocuité de l’association d’emicizumab et de CCPa pourraient être surveillées au moyen d’un test de génération de thrombine. Toutefois, dans cette situation particulière d’épisode hémorragique, il n’existe pas de données permettant de documenter et soutenir cette proposition;
- Une surveillance de la numération plaquettaire, des LDH, de la fonction rénale, de l’haptoglobine et du frottis sanguin avec la recherche de schizocytes est alors indispensable (pour détecter une MAT). Le suivi des D-Dimères parait peu fiable dans ce contexte pour détecter des signes de microangiopathie thrombotique.
Prise en charge d’une chirurgie ou d’une procédure invasive en urgence ou programmée en association avec les centres de référence des maladies hémorragiques
Compte tenu de la demi-vie très longue d’emicizumab, il est inutile et illusoire d’interrompre ce traitement avant un geste invasif ou une intervention chirurgicale. Emicizumab, y compris à concentration plasmatique très faible, entraine un raccourcissement du TCA (devenant le plus souvent normal ou subnormal) alors qu’il ne corrige que partiellement l’hémostase. Compte tenu de la demi-vie prolongée de d’emicizumab, cet effet sur le TCA peut persister jusqu’à 6 mois après la dernière administration d’emicizumab.
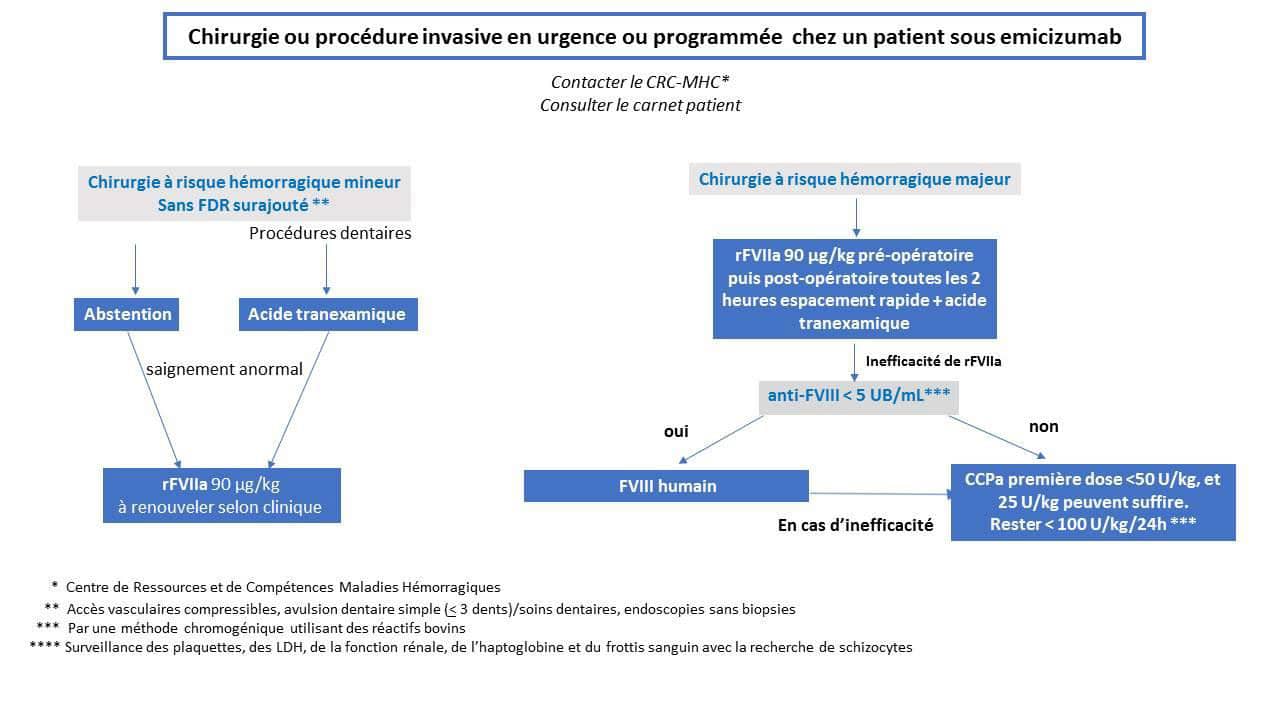
A ce jour et en raison du manque de données sur la réelle persistance du risque hémorragique, les anesthésies loco-régionales neuraxiales (péridurale et rachidienne), sont généralement contre-indiquées. Selon le risque hémorragique de la chirurgie 2 niveaux de traitement peuvent être proposés (Figure 2).
Chirurgie à risque hémorragique mineur
Pour les actes à risque hémorragique jugé mineur (liste non exhaustive):
- accès vasculaires compressibles (insertion ou retrait);
- avulsion dentaire simple (<3 dents) / soins dentaires;
- endoscopies sans biopsies.
et en l’absence de risque hémorragique surajouté (par exemple abcès dentaire, ré-intervention multiple sur un site de chambre implantable), il est envisageable de ne pas prescrire de médicament hémostatique supplémentaire comme le rFVIIa (NovoSeven®). Cette attitude d’abstention doit être privilégiée après évaluation du risque lié à la procédure envisagée chez ce patient par l’équipe en charge du patient (CRC, anesthésiste-réanimateur et chirurgien).
L’acide tranexamique doit être systématiquement prescrit pour les procédures dentaires (per os et en bain de bouche).
En cas de saignement post-opératoire jugé anormal le traitement de première intention est le rFVIIa à la posologie initiale de 90 µg/kg à renouveler selon la situation clinique. La fréquence et la durée du traitement par rFVIIa seront adaptées à la situation clinique. Un espacement des injections doit être envisagé dès que celle-ci le permet.
Chirurgie à risque hémorragique majeur
En l’absence de données suffisantes relatives à la chirurgie sous emicizumab, toute chirurgie non mineure est considérée majeure.
Les étapes de traitement sont similaires à celles des accidents hémorragiques.
1ère ligne de traitement
rFVIIa (NovoSeven®)
Le traitement de première intention est le rFVIIa à la posologie de 90 µg/kg en renouvelant les injections post-opératoires toutes les 2 heures puis en espaçant progressivement les intervalles entre les injections. L’acide tranexamique peut être associé au rFVIIa.
2ème ligne de traitement
Il est donc important de disposer dans le cadre d’une chirurgie d’un titrage récent de l’inhibiteur qui doit reposer sur une méthode de Bethesda chromogénique utilisant des réactifs d’origine bovine (insensibles à l’interférence de l’emicizumab).
Le FVIII humain peut être utilisé si le titre d’inhibiteur est faible au moment du geste (< 5UB/mL). Il est donc important de disposer dans le cadre d’une chirurgie d’un titrage récent de l’inhibiteur qui doit reposer sur une méthode de Bethesda chromogénique utilisant des réactifs d’origine bovine (insensibles à l’interférence d’emicizumab).
La dose requise doit être calculée sur la base du titre d'inhibiteur, afin de maintenir une concentration de FVIII supérieure à 80 UI/dL au moins pendant les 48 premières heures pour une chirurgie majeure.
3ème ligne de traitement
- En cas d’inefficacité du rFVIIa (NovoSeven®) et d’impossibilité à utiliser le FVIII, le CCPa peut être prescrit à posologie réduite (toujours <100 U/kg/24H) sous stricte surveillance clinique et biologique;
- La première dose ne doit pas dépasser 50 U/kg, et 25 U/kg peuvent suffire. Le traitement sera ensuite poursuivi en veillant à ne jamais dépasser 100 U/kg/24h;
- Si le rFVIIa est inefficace et que le FVIII humain ne peut pas être utilisé ou est inefficace, les CCPa peuvent être prescrits à une dose réduite (toujours <100 U/kg/24H) sous surveillance clinique et biologique stricte. La première dose ne doit pas dépasser 50 U/kg et 20-25 U/kg peuvent suffire. Le traitement doit ensuite être poursuivi en veillant à ce qu'il ne dépasse jamais 100 U/kg/24h;
- La surveillance de la numération plaquettaire, de la LDH, de la fonction rénale, de l’haptoglobine et du frottis sanguin à l’aide de tests sur les schizocytes est alors essentielle (pour détecter les premiers signes de la MAT);
- En cas d’échec de cette 3ème ligne de traitement, une concertation multidisciplinaire est obligatoire. Une décision multidisciplinaire doit être prise sans délai concernant une chirurgie potentielle (reprise), embolisation et toute procédure hémostatique locale potentielle. Chaque ligne de traitement qui a été effectuée doit également être soigneusement vérifiée en ce qui concerne la posologie et le nombre d’injections administrées. La combinaison d’agents bypassants pourrait être une option en cas d’échec de toutes les autres stratégies, même si l’utilisation concomitante de rFVIIa et de CCPa est associée à un risque accru de complications thrombotiques, même en l’absence d’emicizumab 17
Modifications des tests d’hémostase sous emicizumab
L’emicizumab n’a pas besoin d’être activé par la thrombine et son effet sur le raccourcissement du TCA est plus prononcé que celui du facteur FVIII. Les mesures de l’activité du FVIII et de l’inhibiteur du FVIII basées sur le TCA sont influencées par la présence d’emicizumab18,19. Tous les tests de coagulation conventionnels basés sur le TCA sont affectés par la présence d’emicizumab, ce qui doit être prise en compte lors de l’interprétation des résultats (tableau 1).
| Tests affectés | Tests non affectés |
|---|---|
| TCA et tous les tests basés sur le TCA (raccourcissement) Recherche et titrage d’inhibiteurs anti FVIII Dosage chronométrique en un temps du FVIII Dosage chromogénique du FVIII (et du FIX) avec réactifs humains (augmentation non proportionnelle) Fibrinogène mésuré par des techniques dérivées du TP (sous-estimation) Dosages des facteurs IX, XI, XII (augmentation non proportionnelle) Recherche d’ACC type lupique Mesure de l’ACT (raccourcissement) | Fibrinogène mesuré par la technique Claus Temps de Quick Dosage des facteurs du complexe prothrombinique (FII, V, VII, X) Dosage chromogénique du FVIII avec réactifs bovins Recherche et titrage d’inhibiteurs anti FVIII par une méthode chromogénique utilisant des réactifs bovins Temps de Thrombine Activité anti-Xa Antithrombine DDimères et autres tests immunologiques (ELISA, ELFA…) |
Références
- Kitazawa T, Igawa T, Sampei Z, et al. A bispecific antibody to factors IXa and X restores factor VIII hemostatic activity in a hemophilia A model. Nat. Med. 2012;18(10):1570–1574;
- Oldenburg J, Mahlangu JN, Kim B, et al. Emicizumab Prophylaxis in Hemophilia A with Inhibitors. N. Engl. J. Med. 2017;377(9):809–818;
- Mahlangu J, Oldenburg J, Paz-Priel I, et al. Emicizumab Prophylaxis in Patients Who Have Hemophilia A without Inhibitors. N. Engl. J. Med. 2018;379(9):811–822;
- Lenting PJ, Denis CV, Christophe OD. Emicizumab, a bispecific antibody recognizing coagulation factors IX and X: how does it actually compare to factor VIII? Blood. 2017;130(23):2463–2468;
- Kotani N, Yoneyama K, Kawakami N, et al. Relative and Absolute Bioavailability Study of Emicizumab to Bridge Drug Products and Subcutaneous Injection Sites in Healthy Volunteers. Clin Pharmacol Drug Dev. 2018;
- Nogami K, Shima M. New therapies using nonfactor products for patients with hemophilia and inhibitors. Blood. 2019;133(5):399–406;
- Uchida N, Sambe T, Yoneyama K, et al. A first-in-human phase 1 study of ACE910, a novel factor VIII-mimetic bispecific antibody, in healthy subjects. Blood. 2016;127(13):1633–1641;
- Yoneyama K, Schmitt C, Kotani N, et al. A Pharmacometric Approach to Substitute for a Conventional Dose-Finding Study in Rare Diseases: Example of Phase III Dose Selection for Emicizumab in Hemophilia A. Clin Pharmacokinet. 2018;57(9):1123–1134;
- Paz-Priel I, Chang T, Asikanius E, et al. Immunogenicity of emicizumab in people with hemophilia A: results from the HAVEN 1-4 studies. Blood. 2018;132:633;
- Hartmann R, Feenstra T, Valentino L, Dockal M, Scheiflinger F. In vitro studies show synergistic effects of a procoagulant bispecific antibody and bypassing agents. Journal of Thrombosis and Haemostasis. 2018;16(8):1580–1591;
- Levy GG, Asikanius E, Kuebler P, et al. Safety analysis of concomitant use of rFVIIa and emicizumab in congenital haemophilia A with inhibitors: Experience from the haven clinical programme. Haemophilia: The Official Journal of the World Federation of Hemophilia. 2019;25(S1):31;
- Astermark J, Donfield SM, DiMichele DM, et al. A randomized comparison of bypassing agents in hemophilia complicated by an inhibitor: the FEIBA NovoSeven Comparative (FENOC) Study. Blood. 2007;109(2):546–551;
- Dargaud Y, Lienhart A, Janbain M, et al. Use of thrombin generation assay to personalize treatment of breakthrough bleeds in a patient with hemophilia and inhibitors receiving prophylaxis with emicizumab. Haematologica. 2018;103(4):e181–e183;
- Leksa NC, Aleman MM, Goodman AG, et al. Intrinsic differences between FVIIIa mimetic bispecific antibodies and FVIII prevent assignment of FVIII-equivalence. J. Thromb. Haemost. 2019;
- Kaatz S, Ahmad D, Spyropoulos AC, Schulman S, Subcommittee on Control of Anticoagulation. Definition of clinically relevant non-major bleeding in studies of anticoagulants in atrial fibrillation and venous thromboembolic disease in non-surgical patients: communication from the SSC of the ISTH. J. Thromb. Haemost. 2015;13(11):2119–2126;
- Collins PW, Liesner R, Makris M, et al. Treatment of bleeding episodes in haemophilia A complicated by a factor VIII inhibitor in patients receiving Emicizumab. Interim guidance from UKHCDO Inhibitor Working Party and Executive Committee. Haemophilia.2018;24(3):344–347;
- Santagostino E, Mancuso ME, Novembrino C, et al. Rescue FVIII replacement to secure haemostasis in a patient with haemophilia A and inhibitors on emicizumab prophylaxis undergoing hip replacement. Haematologica. 2019;haematol.2018.215129;
- Shima M. Emicizumab prophylaxis overcomes factor VIII inhibitors in Hemophilia A. J. Pediatr. 2017;190:287–290;
- Nogami K, Soeda T, Matsumoto T, et al. Routine measurements of factor VIII activity and inhibitor titer in the presence of emicizumab utilizing anti-idiotype monoclonal antibodies. J. Thromb. Haemost. 2018;16(7):1383–1390.
Sophie Susen (MHEMO, GIHP), Yves Gruel (MHEMO, GIHP), Claude Négrier (MHEMO, CRH)
| CRH | MHEMO | GIHP |
|---|---|---|
| Hervé Chambost | Emmanuelle Jeanpierre | Pierre Albaladejo |
| Valérie Chamouard | Jenny Goudemand | Annie Borel-Derlon |
| Annie Harroche | Antoine Rauch | Pierre Fontana |
| Bénédicte Wibaut | Anne Godier | |
| Yves Gruel | ||
| Dominique Lasne | ||
| Thomas Lecompte | ||
| Grégoire Le Gal | ||
| Stéphanie Roullet | ||
| Pierre-Marie Roy | ||
| Pierre Sié | ||
| Jean-François Schved |


