Mis en ligne le 28 Juillet 2011
Questions Fréquentes

Benyamina Mourad & Losser Marie-Reine
Centre de Traitement des Brûlés, Hôpital Cochin
27 rue du Faubourg Saint-Jacques 75679 PARIS Cedex 14
Service d’Anesthésie-Réanimation, Hôpital Saint-Louis,
1 avenue Claude Vellefaux, 75475 PARIS Cedex 10
Question 1 – Quelle place pour le médecin anesthésiste-réanimateur dans la prise en charge du brûlé grave ?
Question 2 – Comment définir une brûlure grave ?
Question 3 – Comment évaluer la surface totale brûlée ?
Question 4 – Comment évaluer la profondeur de la brûlure ?
Question 5 – Déterminer l’existence d’une inhalation aux fumées d’incendies ; attitude pratique.
Question 6 – Les indices pronostiques chez le brûlé grave.
Question 7 – Quand doit-on realiser une assistance ventilatoire chez un brûlé grave ?
Question 8 – Quelle réanimation volémique chez un brûlé récent ?
Question 9 – Comment lutter contre la douleur chez un brûlé récent ?
[hr_shadow]
Question 1 – Quelle place pour le médecin anesthésiste-réanimateur dans la prise en charge du brûlé grave ?
Toutes les brûlures ne justifient pas une prise en charge en réanimation même si des soins spécialisés sont nécessaires. Les brûlures requérant une hospitalisation en réanimation sont celles qui s’accompagnent d’une mise en jeu du pronostic vital liée à la brûlure elle-même, aux lésions associées ou aux co-morbidités préexistantes. La prise en charge des brûlures dans leur expression la plus sévère s’inscrit alors dans une démarche médico-chirurgicale multidisciplinaire.
A la phase initiale, les défaillances rencontrées sont essentiellement de nature hémodynamique, respiratoire et métabolique plaçant ainsi l’anesthésiste-réanimateur au centre de la prise en charge. Même si des actes chirurgicaux peuvent être nécessaires à ce stade (incisions de décharge, excisions précoces), ceux-ci doivent s’intégrer dans une prise en charge globale tenant compte de la situation clinique, en particulier de l’état hémodynamique du malade. En effet, la brûlure induit des perturbations brutales et intenses de l’homéostasie mais de durée brève. Les règles de remplissage vasculaire ont le mérite de proposer une orientation dans l’évaluation des volumes à perfuser, mais justifient la mise en œuvre d’un monitorage précis afin de s’adapter à chaque situation.
Deux points doivent d’être soulignés :
· la précocité de la restauration volémique est un facteur pronostique essentiel permettant de limiter la survenue des défaillances d’organes ;
· l’expansion volémique doit participer à la normalisation de la délivrance en oxygène tout en limitant au maximum la formation d’œdèmes potentiellement délétères sur l’évolution des lésions cutanées.
Bibliographie :
Benyamina M, Stephanazzi J, Rackelboom T, Wassermann D, Vinsonneau C. Réanimation du brûlé. In Réanimation médicale (CNERM), Masson (ed), 2009.
Question 2 – Comment définir une brûlure grave ?
L’évaluation initiale de la gravité est primordiale sur les lieux du sinistre afin d’adapter la prise en charge pré-hospitalière. Les éléments à considérer sont :
· la surface brûlée et sa profondeur approchées de façon simple,
· l’exposition éventuelle aux fumées d’incendie,
· les défaillances d’organes et des traumatismes associés.
Le pronostic sera alors précisé à l’admission en tenant compte des principaux facteurs de gravité : surface totale et profondeur de la brûlure, âge du patient, existence de lésions d’inhalation de fumées, localisation des brûlures, co-morbidités et précocité de la réanimation dont le rôle peut être déterminant [1-4]. Ryan et coll. [1] ont montré que trois de ces facteurs augmentent de façon indépendante la mortalité : la surface brûlée totale > 40 %, l’âge > 60 ans et la présence d’inhalation de fumées. Ces résultats ont été confirmés récemment par une analyse multivariée [2] : inhalation de fumée (RR : 17,64 ; IC95 % [9,37-33,20], p< 0,001), l’âge > 60 ans (RR : 16,93 ; IC95 % [8,70-32,92], p< 0,001) et la surface totale brûlée > 40 % (RR : 6,62 ; IC95 % [3,39-12,90], p< 0,001).
Le tableau 1 précise les critères de définition d’une brûlure grave justifiant l’admission en centre spécialisé.
Tableau 1 : définition d’une brûlure grave
· surface brûlée dépassant 25 % de la surface corporelle totale ou 20 % aux âges extrêmes de la vie,
· lésions profondes dépassant 10 % de la surface corporelle totale,
· brûlures intéressant la face, les mains, les pieds, le périnée,
· association à des lésions d’inhalation de fumées,
· brûlures électriques,
· pathologies graves ou non équilibrées préexistantes.
Bibliographie :
[1] Ryan CM, Schoenfeld DA, Thorpe WP, Sheridan RL, Cassem EH, Tompkins RG. Objective estimates of the probability of death from burn injuries. N Engl J Med 1998 ; 338 : 362-6.
[2] Brusselaers N, Hoste EAJ, Monstrey S, Colpaert KE, De Waele JJ, Vandewoude KH, Blot SI. Outcome and changes over time in survival following severe burns from 1985 to 2004. Intensive Care Med 2005; 31 : 1648-53.
[3] Spies M, Herndon DN, Rosenblatt JI, Sanford AP, Wolf SE. Prediction of mortality from catastrophic burns in children. Lancet 2003 ; 361 : 989-94.
[4] Germann G, Barthold U, Lefering R, Raff T, Hartmann B. The impact of risk factors and pre-existing conditions on the mortality of burn patients and the precision of predictive admission-scoring systems. Burns 1997 ; 23 : 195-203.
Question 3 – Comment évaluer la surface totale brûlée ?
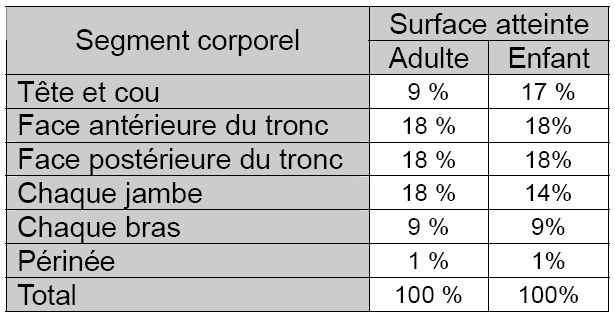
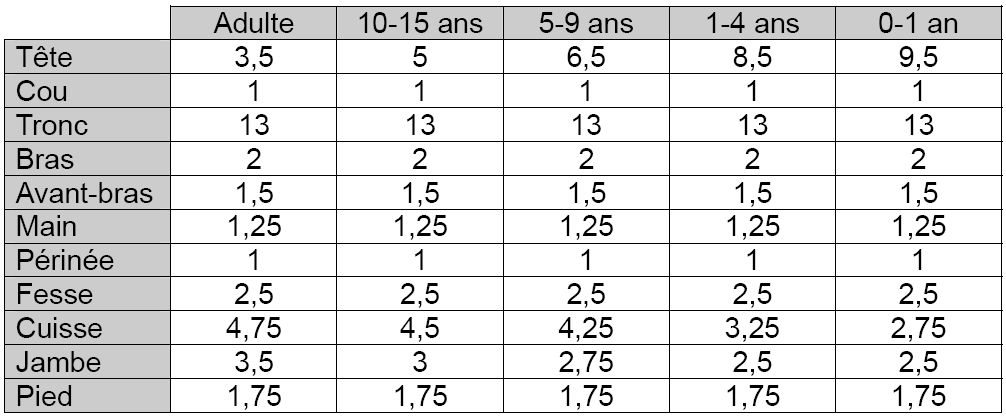
Il s’agit du principal paramètre déterminant la sévérité des répercussions générales de la brûlure (pertes hydroélectrolytiques et thermiques par exemple). Elle est calculée en pourcentage de la surface corporelle totale à l’aide de règles et schémas préétablis. En pré-hospitalier, la règle des neuf de Wallace (tableau 2) est la plus facile à utiliser. Elle est cependant peu adaptée à l’évaluation des brûlures de petites dimensions ou celles disséminées sur toute la surface corporelle. La paume d’une main du patient représente environ 1% de sa surface corporelle totale. Ceci représente une unité simple facilitant le calcul. Des schémas plus précis tenant compte de l’âge (table de Berkow) permettent d’affiner cette évaluation lors de l’admission (tableau 3). Concernant les brûlures électriques, la surface cutanée brûlée sous-estime habituellement l’importance réelle des tissus lésés. En effet, le passage du courant détermine des lésions tissulaires qui ne sont pas prises en compte lors du calcul de la surface brûlée.
Tableau 2 : règle des Neuf de Wallace, évaluation de la surface brûlée en pourcentage de la surface corporelle par un multiple de neuf chez l’adulte et sa variante chez l’enfant.
Tableau 3 : table de Berkow – évaluation de la surface cutanée brûlée en pourcentage de la surface corporelle en fonction de l’âge. Chaque chiffre correspond au pourcentage représenté par UNE FACE de chaque segment corporel.
Question 4 – Comment évaluer la profondeur de la brûlure ?
C’est un paramètre qui intervient davantage dans le pronostic fonctionnel que dans le pronostic vital car c’est de la profondeur que dépendent les capacités de cicatrisation cutanée ainsi que sa qualité.
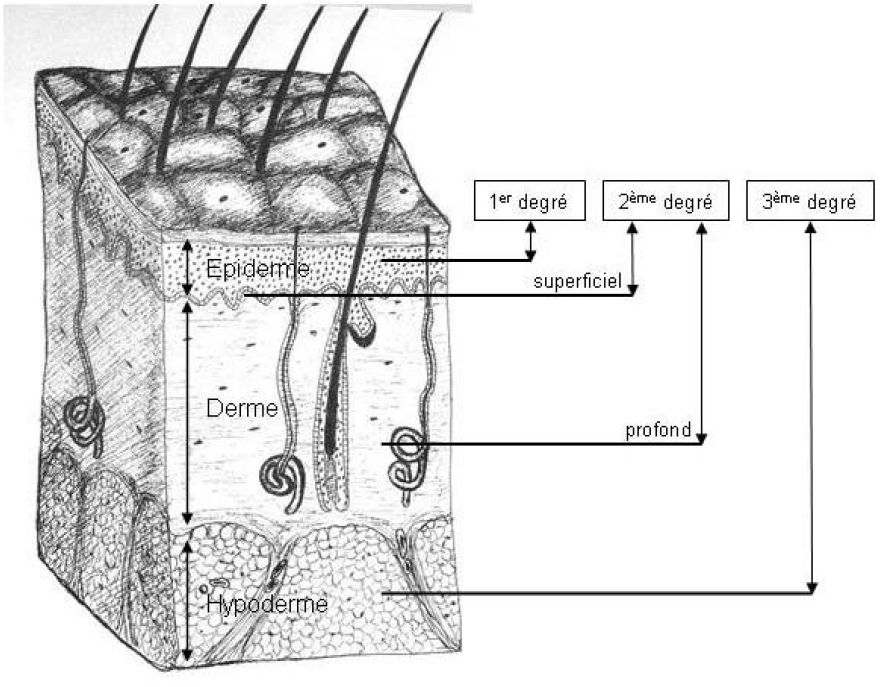
On distingue trois degrés de profondeur de brûlures (figure 1) :
· Le premier degré correspond à une lésion isolée de l’épiderme qui cicatrise spontanément en quelques jours sans séquelles. Elle se caractérise par un érythème douloureux. Elle n’intervient pas dans le calcul de la surface brûlée totale car elle n’induit que peu de perturbations hydro-éléctrolytiques.
· Le deuxième degré correspond à une lésion complète de l’épiderme associée à une atteinte plus ou moins profonde du derme, dont la caractéristique pathognomonique est la présence de phlyctènes. On décrit le deuxième degré superficiel lorsque l’épiderme est détruit jusqu’à la membrane basale. La cicatrisation est obtenue en une à deux semaines, habituellement sans séquelles. Le deuxième degré profond se caractérise par une atteinte importante du derme, laissant intactes les annexes pilo-sébacées et les glandes sudoripares. Dans ce cas, la cicatrisation est incertaine, demande plus de deux semaines et entraîne une cicatrice indélébile. La distinction clinique de ces deux profondeurs se fait sur l’aspect et la sensibilité du plancher de la phlyctène après son excision. Dans les lésions superficielles, ce plancher apparaît rouge, bien vascularisé, excessivement sensible et spontanément douloureux. Au contraire, dans les lésions du deuxième profond, le plancher est blanc-rosé, mal vascularisé et présente une sensibilité diminuée.
· Les brûlures du troisième degré atteignent la totalité des structures de la peau, détruisant l’épiderme, le derme et parfois l’hypoderme, les muscles ou même les tendons et les os sous-jacents. La peau brûlée reste adhérente, de couleur variable et n’a plus aucune sensibilité. Aucune cicatrisation n’est alors possible : la guérison ne peut être obtenue que par la réalisation d’une excision de la nécrose suivie de la pose d’une auto-greffe.
Figure 1 : correspondance histologique des différentes profondeurs de brûlures
Question 5 – Déterminer l’existence d’une inhalation aux fumées d’incendies ; attitude pratique.
Elle est fréquente au cours des incendies et responsable d’une mortalité initiale élevée liée principalement aux effets systémiques des gaz hypoxiants : le monoxyde de carbone et les cyanures. En dehors de ces gaz, les effets cliniques de l’inhalation de fumées d’incendie sont de trois ordres :
· effet local irritant de gaz,
· brûlures chimiques de la muqueuse pulmonaire par les suies inhalées,
· brûlures chimiques et thermiques des voies aériennes supérieures responsables d’œdème laryngé.
Il n’existe aucun signe pathognomonique de l’inhalation de fumées. En présence d’un incendie en espace clos, l’association de plusieurs éléments doit la faire suspecter :
· suies dans l’oropharynx ou dans les expectorations,
· symptomatologie respiratoire associant toux sèche, dysphonie avec raucité de la voix, wheezing, ronchi et sibilants.
La présence de brûlures du visage, si elle ne signe pas l’inhalation de fumées, doit cependant faire envisager le diagnostic [1]. La fibroscopie bronchique est de loin l’examen diagnostic le plus performant.
Les lésions secondaires à l’inhalation de fumées, en présence de brûlures cutanées, constituent un facteur pronostique péjoratif qui aggrave le retentissement hémodynamique de la brûlure et la morbi-mortalité [2, 3, 4].
Les thérapeutiques spécifiques des intoxications aux gaz hypoxiants, outre l’administration systématique d’oxygène à fort débit, peuvent faire discuter le recours à l’oxygénothérapie hyperbare pour les intoxications au CO et à l’hydroxocobalamine (Cyanokit®) en cas d’intoxication aux cyanures. Compte tenu de la gravité potentielle de cette dernière, il semble raisonnable de proposer l’injection d’hydroxocobalamine lorsqu’existent une instabilité hémodynamique, des troubles de conscience ou un arrêt cardio-respiratoire en cas d’inhalation de fumées d’incendie [1].
Bibliographie :
[1] Vinsonneau C, Augris C, Benyamina M, Lebreton F, Wassermann D. Inhalation de fumées. EMC (Elsevier Masson SAS, Paris, Médecine d’urgence, 25-030-C-10, 2007.
[2] Ryan CM, Schoenfeld DA, Thorpe WP, Sheridan RL, Cassem EH, Tompkins RG. Objective estimates of the probability of death from burn injuries. N Engl J Med 1998 ; 338 : 362-6.
[3] Brusselaers N, Hoste EAJ, Monstrey S, Colpaert KE, De Waele JJ, Vandewoude KH, Blot SI. Outcome and changes over time in survival following severe burns from 1985 to 2004. Intensive Care Med 2005 ; 31 : 1648-53.
[4] Saffle JR, Davis B, Williams P, American Registry Participant Group. Recent outcomes in the treatement of burn injury in the United States ; a report from the American Burn Association Patient Registry. J Burn Care Rehabil 1995 ; 16 : 219-32.
Question 6 – Les indices pronostiques chez le brûlé grave.
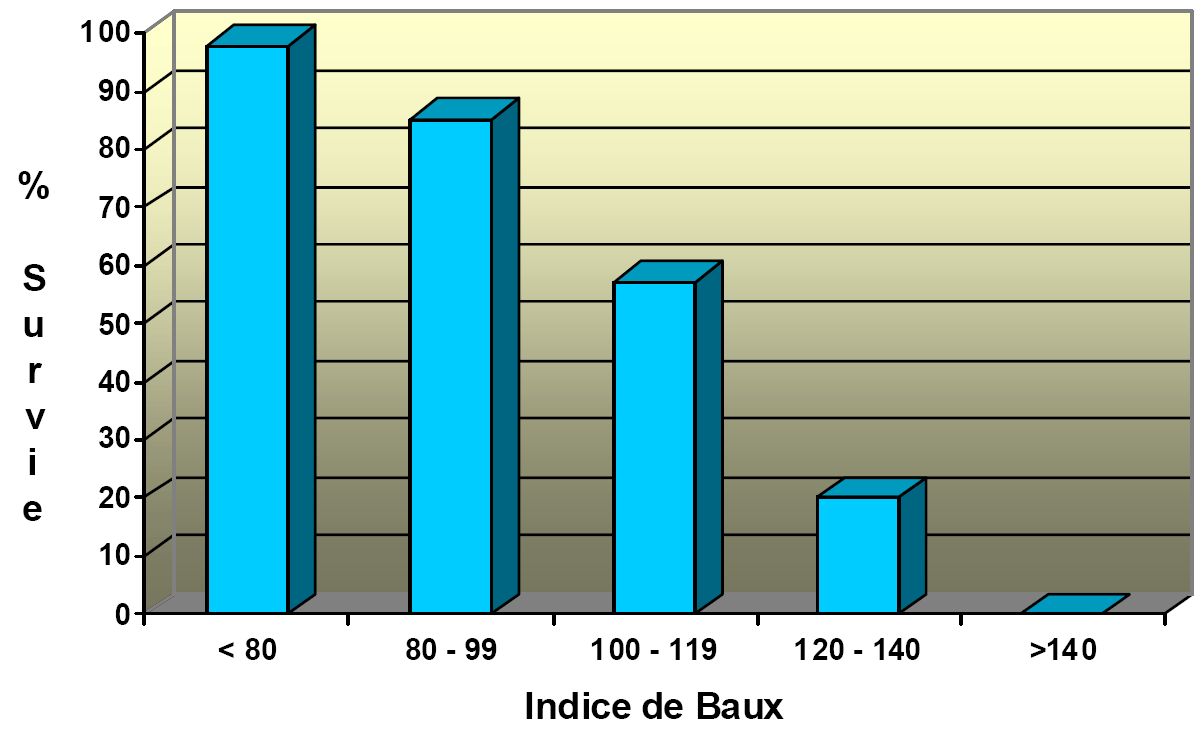
Le plus simple et le plus utilisé est le score de Baux qui correspond à la somme de l’âge du patient et de la surface brûlés totale. Ce score n’est cependant applicable qu’à partir de l’âge de 20 ans. A l’heure actuelle, un indice supérieur à 100 correspond à une mortalité proche de 50 % (Fig 2) [8]. D’autres indices ont été proposés parmi lesquels le score ABSI (Abbreviated burn severity index) reste l’un des plus utilisés (tableau 4) [7].
Bibliographie :
[1] Tobiasen J, Hiebert JM, Edlich RF. The abbreviated burn severity index. Ann Emerg Med 1982; 11: 260-2.
[2] Wassermann D. Critères de gravité des brûlures. Epidémiologie, prévention, organisation de la prise en charge. Pathol Biol 2002 ; 50 : 65-73.
Tableau 4 : score de gravité ABSI (Abbreviated Burn Severity Index) [1]
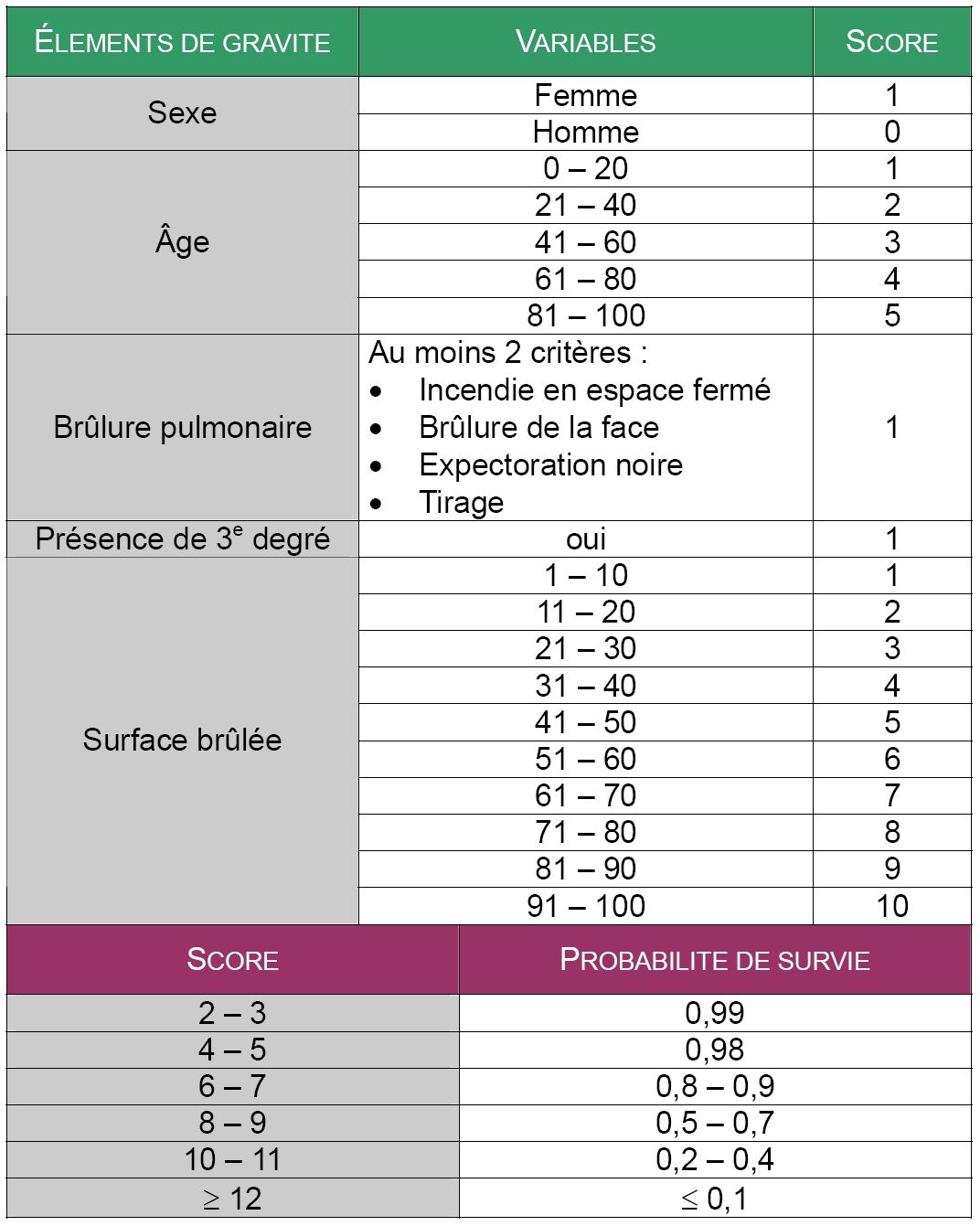
Figure 2 : pourcentage de survie en fonction de l’indice de Baux. Analyse sur une population de 1942 patients adultes hospitalisés dans le centre des brûlés de Cochin de Janvier 1997 à Janvier 2000.
Question 7 – Quand doit-on realiser une assistance ventilatoire chez un brûlé grave ?
1. Période préhospitalière
Lors de cette phase initiale, le médecin est rarement dans des conditions de propreté et de confort qui lui permettent d’examiner correctement une brûlure. Il doit cependant évaluer rapidement la gravité des lésions, afin d’initier sans tarder les thérapeutiques adaptées et orienter le patient vers la structure de soins appropriée.
La priorité est d’extraire le patient du lieu du danger, dans les conditions requises par un éventuel traumatisme et en prenant garde de se protéger. Les vêtements non adhérents sont retirés. Une évaluation clinique rapide concerne l’état hémodynamique, respiratoire, et neurologique, la gravité des brûlures et la présence éventuelle de lésions traumatiques. A l’issue de cette évaluation, les thérapeutiques urgentes seront mises en œuvre :
· contrôle des voies aériennes et de l’hématose avec au besoin, intubation et ventilation mécanique,
· contrôle de l’état hémodynamique avec maintien d’une volémie satisfaisante,
· mise en œuvre des thérapeutiques spécifiques lors d’intoxications aux gaz asphyxiants,
· lutte contre l’hypothermie et la douleur,
· en cas de polytraumatisme associé, la gestion des lésions traumatiques représente l’urgence thérapeutique. Elle doit précéder la prise en charge des brûlures et prendre en compte l’augmentation des besoins volémiques liée à l’atteinte cutanée.
L’oxygénothérapie est systématique. Elle est prolongée et délivrée à fort débit en cas d’intoxication aux fumées d’incendie. Les indications d’intubation et de la mise sous assistance ventilatoire sont indiscutables en cas de signes de détresse respiratoire ou d’altération profonde de la vigilance. Les brûlures profondes du segment céphalique, visage ou cou, doivent entraîner l’intubation et la mise sous ventilation assistée lorsqu’il existe une inhalation de fumées ou une brûlure des voies aériennes supérieures. En effet, l’œdème des voies aériennes supérieures est d’apparition souvent retardée, et son importance est majorée par la réanimation volémique. Cette réaction oedémateuse peut rendre l’intubation difficile voire impossible. La ventilation assistée ne présente pas de particularités à cette phase.
2. Période hospitalière
Passée la phase pré-hospitalière, le contrôle du transport en oxygène par le maintien du débit cardiaque et de l’hématose est le principal objectif de la réanimation.
La ventilation artificielle ne présente habituellement aucune spécificité. En présence d’une inhalation de fumées ou en cas de brûlure grave, la survenue d’un SDRA est possible.
De nouvelles stratégies ventilatoires ont récemment été rapportées dans les formes les plus sévères. Elles sont basées sur la ventilation à haute fréquence (jet ventilation, ventilation par oscillation à haute fréquence) [1,2]. Elles semblent apporter un bénéfice en terme d’oxygénation avec une tolérance acceptable. Le recul insuffisant et le petit nombre d’études disponibles ne permettent pas d’en recommander l’utilisation systématique.
Certaines thérapeutiques inhalées ont été proposées et évaluées sur de petits collectifs de patients [3]. Il s’agit de la nébulisation d’héparine et d’acétylcystéine qui permettrait, en évitant la formation des moules bronchiques, de diminuer la fréquence des atélectasies et d’améliorer le pronostic vital. Ces traitements demandent encore à être validés.
Bibliographie :
[1] Cartotto R, Ellis S, Smith T. Use of high-frequency oscillatory ventilation in burn patients. Crit Care Med 2005 ; 33[Suppl.] : S175-S181.
[2] Reper P, Van Bos R, Van Loey K, Van Laeke P, Vanderkelen A. High frequency percussive ventilation in burn patients : hemodynamics and gas exchange. Burns 2003 ; 29 : 603-8.
[3] Enkhbaatar P, Traber LD, Traber DL. Importance of airway management in burn and smoke inhalation induced acute lung injury. In Yearbook of intensive care and emergency medicine, 2006. Springer ed.
Question 8 – Quelle réanimation volémique chez un brûlé récent ?
1. Période préhospitalière
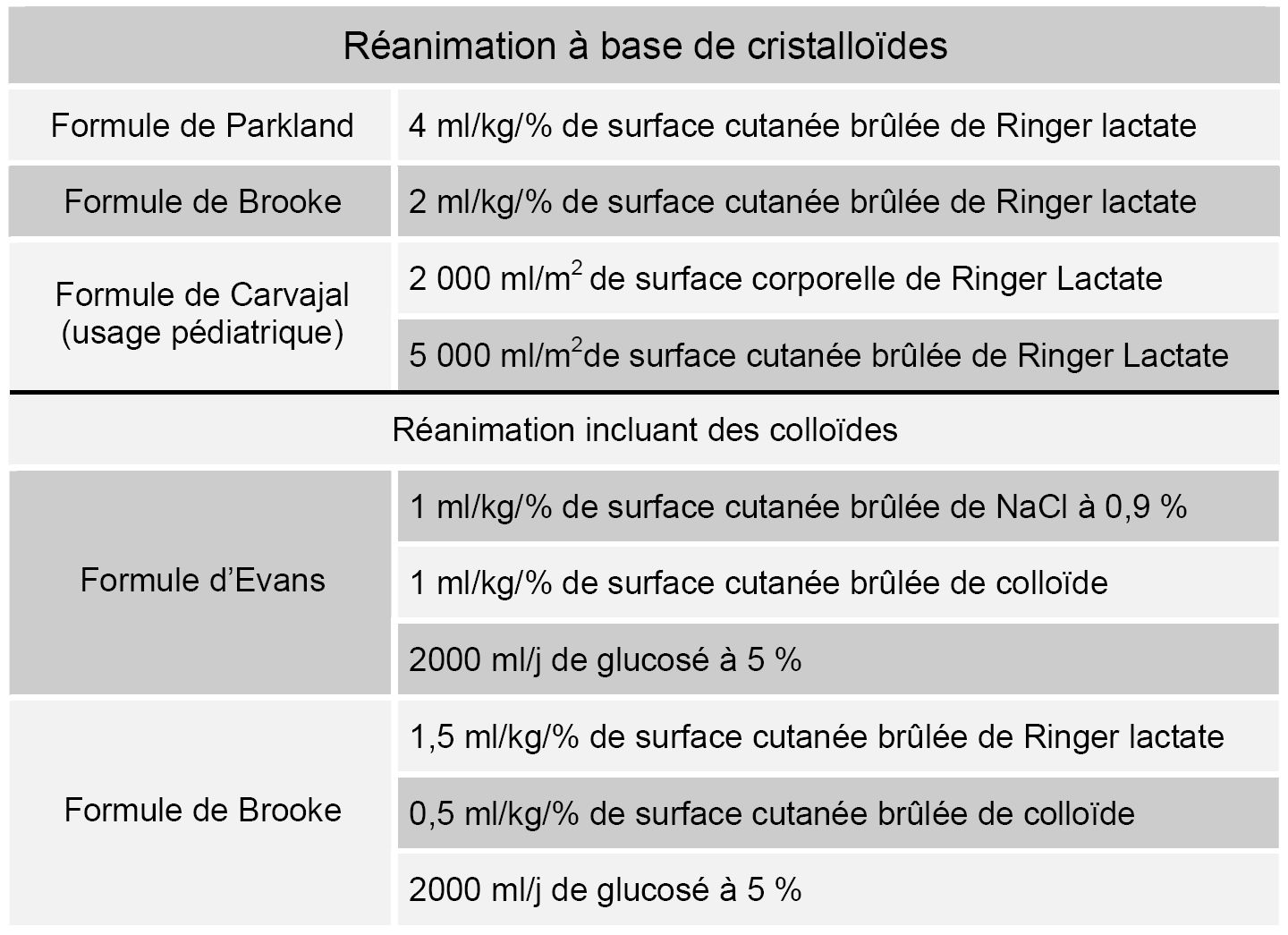
La précocité du remplissage vasculaire est un déterminant majeur du pronostic. Tout retard favorise la survenue de défaillances d’organes [1]. Compte tenu de la cinétique rapide des pertes hydro-électrolytiques, elles vont surtout survenir au cours des premières heures. Le maintien d’un statut volémique le plus proche de la normale est une priorité à la prise en charge pré-hospitalière. Pour permettre de tenir compte des impératifs liés au conditionnement du patient sur le terrain et à la restauration volémique, il est recommandé de perfuser 20 ml/kg de cristalloïdes (Ringer Lactate) au cours de la première heure quelle que soit la surface brûlée, dès lors qu’elle dépasse 10 % de la surface corporelle totale. Plusieurs formules sont proposées pour tenter d’évaluer de façon plus précise les besoins en fonction du contexte (tableau 5) [2]. La formule la plus utilisée et celle recommandée par la Société Française d’Etude et de Traitement des Brûlures est celle dite de Baxter, du Parkland Hospital. Elle utilise exclusivement une solution cristalloïde et apporte 2 ml/kg/% de surface brûlée au cours des 8 premières heures suivant l’agression thermique. La même quantité est perfusée sur les 16 heures suivantes. Certaines équipes utilisent dès ce stade des macromolécules. Une majoration des besoins de 30 à 50 % est prévisible lorsque s’associent à la brûlure un traumatisme ou des lésions d’inhalation de fumée [3]. En cas de brûlures électriques, la surface cutanée brûlée ne correspond pas à la réalité des lésions et ne doit donc pas servir à évaluer l’apport liquidien. La diurèse et la pression artérielle sont considérées comme les deux principaux paramètres à surveiller pour conduire le remplissage. Le chiffre optimal de diurèse horaire est habituellement fixé à 0,5 ml/kg/h, bien qu’il n’existe actuellement aucune étude clinique ayant permis de déterminer le débit urinaire correspondant à une perfusion tissulaire adaptée.
Chez l’enfant, les formules se rapportant au poids du corps ont tendance à sous-estimer les besoins liquidiens. L’utilisation de la surface corporelle permet une estimation plus fiable. C’est habituellement la formule de Carjaval (apport de 2000 ml.m-2 de surface corporelle + 5000 ml.m-2 de surface cutané brûlée) qui est proposée dans ce contexte [4]. Il ne faut pas négliger la majoration des besoins volémiques en cas d’inhalation aux fumées d’incendie [5].
2. Période hospitalière
Au-delà des 8 premières heures, l’appréciation du volume à perfuser correspond à 2 ml/kg/% de surface brûlée à partir de la formule de Parkland à passer sur 16 heures. Le deuxième jour, les volumes perfusés représentent environ la moitié de ceux administrés les premières 24 heures, soit 2 ml/kg/% de surface brûlée. Il faut bien noter que ces volumes restent totalement théoriques et doivent être adaptés à l’état du patient. Plusieurs auteurs ont montré que les volumes administrés dépassent souvent ceux prédits par la formule de Baxter. La réanimation volémique guidée par la surveillance hémodynamique invasive et/ou visant à normaliser la précharge (pressions de remplissage [6], mesure du transport en oxygène [7], mesure du volume sanguin intrathoracique) conduit le plus souvent à des volumes perfusés très supérieurs à ceux théoriques prédits par la formule. L’augmentation des apports liquidiens n’a cependant aucun effet sur le pronostic des patients qu’il s’agisse de la survenue de défaillances viscérales (insuffisance rénale en particulier), de la durée de ventilation, de la durée de séjour ou de la mortalité [8]. Il semble même que, sur la base d’une étude récente, la persistance d’une hypovolémie relative ne soit pas à l’origine de signes cliniques ou biologiques (lactatémie) d’hypoperfusion [9]. Dans ce travail, l’hypovolémie est diagnostiquée par échographie alors que le débit horaire de diurèse est voisin de 1 ml/kg. Si l’on considère que l’œdème secondaire à l’excès de remplissage exerce des effets potentiellement délétères sur la perfusion cutanée, on tente de limiter les volumes perfusés aux quantités nécessaires et suffisantes au maintien d’une perfusion cutanée. Cette stratégie est à l’origine du concept « d’hypovolémie permissive » [10]. Dans ce contexte, la surveillance des valeurs de base déficit pourrait être intéressante pour adapter le remplissage aux exigences de la perfusion tissulaire [11].
Sur le plan qualitatif, le débat colloïdes-cristalloïdes reste d’actualité. Les colloïdes sont fréquemment introduits, notamment l’albumine, en proportion et dans des délais variables (le plus souvent après la 8ème heure), dans les différentes formules de remplissage [2]. Les colloïdes permettent une augmentation de la pression oncotique et une réduction des volumes administrés. Cet aspect du problème est important puisque l’œdème formé, notamment dans les tissus sains, est également réduit.
Parmi les colloïdes, la place de l’albumine a récemment été remise en question par plusieurs méta-analyses. Leurs conclusions n’ont pas permis de recommander son utilisation comme soluté de remplissage. Même si l’on doit rester prudent en raison du biais lié au faible nombre d’études intéressant les patients brûlés [12], il faut reconnaître que les travaux établissant de façon formelle la supériorité de l’albumine dans la réanimation volémique du brûlé grave manquent. Une étude récente semble cependant apporter des éléments importants en faveur de son intérêt [13], mais ces résultats restent à confirmer. De façon plus pratique et indépendamment de résultats de ces différentes études, la toxicité des colloïdes artificiels et leur dose maximale utilisable peuvent représenter une limite et obliger à recourir à l’albumine, notamment chez les patients les plus graves.
A côté de son rôle dans l’expansion volémique, l’albumine présente des propriétés de transport, des effets de modulation de l’intensité de l’agression oxydative et de l’inflammation qui présentent un intérêt certain chez les sujets les plus graves [14]. L’utilisation de la formule d’Evans (tableau 1) semble donc la plus appropriée après la 8ème heure. L’apport est habituellement poursuivi pendant 48 heures, puis au-delà en fonction des valeurs de l’albuminémie.
Afin de diminuer les besoins liquidiens, différentes stratégies ont été testées avec des résultats encourageants. La perfusion de colloïdes hypertoniques (dextran 70 + NaCl 7,5 %) [15] ou celle de vitamine C à fortes doses visant à diminuer la production de radicaux libres [16] entrent dans ce cadre. Chez l’homme, il n’existe à ce jour aucune étude pour confirmer ces résultats. Concernant la vitamine C, plusieurs études animales ont montré un bénéfice sur la diminution des besoins liquidiens mais une seule étude humaine prospective a confirmé ces résultats à l’aide de très fortes doses (jusqu’à 110 g/j) [16].
Bibliographie :
[1] Barrow RE, Jeschke MG, Herndon DN. Early fluid resuscitation improves outcomes in severely burned children. Resuscitation 2000 ; 45 : 91-6.
[2] Warden GB. Burn shock resuscitation. World J Surg 1992 ; 16 : 16-23.
[3] Navar PD, Saffle JR, Warden GD. Effect of inhalation injury on fluid resuscitation requirements after thermal injury. Am J Surg 1985 ; 150 : 716-720
[4] Carvajal HF. Fluid resuscitation of pediatric burn victims : a critical appraisal. Pediat Nephrol, 1994 ; 8 : 357-366.
[5] Vinsonneau C, Augris C, Benyamina M, Lebreton F, Wassermann D. Inhalation de fumées. EMC (Elsevier Masson SAS, Paris, Médecine d’urgence, 25-030-C-10, 2007.
[6] Engrav LH et al. A biopsy of the use of the Baxter formula to resuscitate burns or do we do it like Charlie did it ? J Burn Care Rehabil 2000 ; 21 : 91-5.
[7] Barton RG, Saffle JR, Morris SE, Mone M, Davis B, Shelby J. Resuscitation of thermally injured patients with oxygen transport criteria as goals of therapy. J Burn Care Rehabil, 1997 ; 98 : 1-9.
[8] Holm C, Mayr M, Tegeler J et coll. A clinical randomized study on the effects of invasive monitoring on burn shock resuscitation.Burns. 2004 ; 30 : 798-807.
[9] Papp A, Uusaro A, Parviainen I, Hartikainen J, Ruokenen E. Myocardial function and heamodynamics in extensive burn trauma : evaluation by clinical signs, invasive monitoring, echocardiography,and cytokine concentration. A prospective clinical study ; Act Anaesthesiol Scand, 2003 ; 47 : 1257-1263.
[10] Arlati S, Storti E, Pradella V, Bussi L, Vitolo A, Pulici M. Decreased fluid volume to reduce organ damage: a new approach to burn shock resuscitation? A preliminary study. Resuscitation. 2007 ; 72 : 371-8.
[11] Cartotto R, Choi J, Gomez M, Cooper A. A prospective study on the implications of a base deficit during fluid resuscitation. J Burn Care Rehabil. 2003 ; 24 : 75-84.
[12] Cochrane injuries group of albumin reviewers. Human albumin administration in critically ill patients : systematic review of controlled trials. Br Med J 1998 ; 317 : 235-40.
[13] Cochran A, Edelman LS, Saffle JR, Morris SE. The relationship of serum lactate and base deficit in burn patients to mortality. J Burn Care Res. 2007 ; 28 : 231-40.
[14] Quinlan GJ, Martin GS, Evans TW. Albumin : biochemical properties and therapeutics potential. Hepatology 2005 ; 41 : 1211-9.
[15] Elgjo GI, Traber DL, Hawkins HK, Kramer GC. Burn resuscitation with two doses of 4 mL/kg hypertonic saline dextran provides sustained fluid sparing: a 48-hour prospective study in conscious sheep. J Trauma. 2000 ; 49 : 251-63.
[16] Tanaka H, Matsuda T, Miyagantani Y et al. Reduction of resuscitation fluid volumes in severely burned patients using ascorbic acid administration : a randomized, prospective study. Arch Surg 2000 ; 135 : 326-31
Tableau 5 : formules de remplissage des premières 24 h
Question 9 – Comment lutter contre la douleur chez un brûlé récent ?
Elle est essentielle tant la douleur est importante, souvent majorée par le stress lié aux circonstances de l’accident. Elle fait appel à la stratégie d’analgésie dite multimodale associant plusieurs antalgiques à mode d’action différent (morphine, paracétamol, néfopam, tramadol). Dans ce contexte la morphine reste la molécule de référence. Elle est administrée en titration par voie intra-veineuse par bolus de 3 mg (dose totale habituellement efficace voisine de 0,1 mg/kg). Le recours à l’anxiolyse est un complément souvent utile.
Bibliographie :
Benyamina M, Stephanazzi J, Rackelboom T, Wassermann D, Vinsonneau C. Réanimation du brûlé. In Réanimation médicale (CNERM), Masson (ed), 2009.