Mis en ligne le 8 Juin 2009
Questions Fréquentes

Vincent Piriou
Service d’Anesthésie Réanimation – Centre Hospitalier Lyon Sud – 69495 Pierre-Bénite Cedex
Courriel : vincent.piriou chez chu-lyon point fr
Question 1 – Quelles complications cardiaques les patients présentent-ils en post-opératoire ?
Question2 – Cas particulier du patient insuffisant cardiaque
Question 3 – Les infarctus du myocarde périopératoires : caractéristiques, moyens de diagnostic
Question 3-a : Quelle est la définition de l’infarctus du myocarde périopératoire ?
Question 3-b : Circonstances d’apparition d’un infarctus du myocarde périopératoire [5]
Question 4 – Quelle est la cinétique de la troponine ?
Question 5 – Existe-t-il un seuil de troponine pour affirmer le diagnostic d’infarctus du myocarde ?
Question 6 – Quelle est la valeur d’une troponinémie positive en post-opératoire ?
Question 7 – Que faire en cas de troponinémie positive en postopératoire ?
Question 8 – A qui faut-il réaliser une troponinémie en post-opératoire ? [13]
Question 1 – Quelles complications cardiaques les patients présentent-ils en post-opératoire ?
Les complications les plus fréquentes sont représentées par les infarctus du myocarde post-opératoires, les poussées d’insuffisance cardiaque, et les troubles du rythme post-opératoires. Ces complications cardiaques per-opératoires sont relativement peu fréquentes, et la plupart des complications surviennent lors la période post-opératoire, s’étendant jusqu’aux 48 – 72 premières heures après l’intervention chirurgicale [1,2]. Il s’agit d’une période particulièrement à risque qui nécessite une surveillance rapprochée des patients identifiés à risque.
De façon générale, tous les patients à risque de complications cardiaques post-opératoires doivent bénéficier d’une surveillance rapprochée qui implique : surveillance de la fréquence cardiaque, surveillance de la pression artérielle, invasive ou non invasive, monitoring du segment ST, surveillance du rythme cardiaque par électrocardioscope, surveillance ECG au moins pendant 24 h, surveillance biologique : troponine, hémoglobine, ionogramme, fonction rénale. Cette surveillance peut avoir lieu soit en réanimation, soit de façon préférentielle, en unité de surveillance continue.
Il est préférable d’extuber les patients à risque venant d’être opérés dans un service de réanimation ou de surveillance continue, une fois que tous les paramètres pouvant contribuer à un déséquilibre de la balance en oxygène auront été corrigés : parmi ces paramètres, on retrouve une pression artérielle normalisée (éviter les épisodes d’hypotension artérielle qui entraînent une diminution de la pression de perfusion, notamment en aval d’une sténose artérielle, et les hypertensions artérielles qui provoquent une augmentation de la post-charge et donc une augmentation des besoins en oxygène), une fréquence cardiaque aux alentours de 65 – 70 battements/minutes (celle-ci sera assurée par une analgésie adéquate, par un remplissage adéquat, et, éventuellement par un traitement adjuvant par bêtabloquants). Les patients seront bien entendu oxygénés après leur extubation et transfusés si nécessaire. On rappelle pour mémoire que l’hémoglobine optimale d’un patient coronarien se situe entre 9 et 10 g/dl. Afin d’éviter les déséquilibres de la balance en oxygène, les patients seront bien entendu réchauffés en per-opératoire, et une température de 36,5° C sera requise pour pouvoir extuber ces patients à risque.

On rappelle deux points importants :
–Les traitements pré-opératoires devront être repris le plus rapidement possible afin d’éviter des syndromes de sevrage, notamment en ce qui concerne les bêtabloquants et les statines chez les patients coronariens.
–Chez ces patients à risque, il importe d’assurer un monitorage continu. Ceci commence avant l’induction anesthésique et se poursuit jusqu’au retour du patient dans sa chambre. Cela implique que les patients soient monitorés pendant le transport entre le bloc opératoire et le lieu de surveillance post-opératoire (service de réanimation par exemple).
Question2 – Cas particulier du patient insuffisant cardiaque
En raison des interactions cardiopulmonaires, la ventilation mécanique a un effet de diminution de la précharge ventriculaire droite et de diminution de la postcharge ventriculaire gauche. Ceci signifie que chez le patient insuffisant cardiaque, la ventilation mécanique est bénéfique en améliorant le débit cardiaque. Chez un patient présentant une insuffisance cardiaque sévère, le risque se situe donc lors de l’extubation. Le monitorage per-opératoire du patient devra inclure le monitorage du débit cardiaque, le monitorage de la pression artérielle par voie invasive ou non invasive en fonction de la sévérité du patient et du type de chirurgie, le monitorage de la température, de l’EtCO2, de la fréquence cardiaque, du rythme cardiaque et de la température. Ce monitorage devra être présent en per-opératoire, pendant le transport et pendant la surveillance post-opératoire.
En raison de l’effet du sevrage de la ventilation mécanique sur la fonction ventriculaire décrit ci-dessus, il est souhaitable de ne pas extuber les patients en salle d’opération. Ces patients présentant une insuffisance cardiaque doivent être extubés après optimisation des paramètres hémodynamiques, de la température du patient, de l’hémoglobine. Cette extubation doit pouvoir être réalisée sous contrôle du monitorage du débit cardiaque, avec possibilité de réaliser une échocardiographie si nécessaire. Les signes cliniques d’insuffisance cardiaque aiguë (altération de la diurèse, fraîcheur cutanée, marbrures…) devront être systématiquement et régulièrement recherchés. En cas d’existence d’un bas débit cardiaque, un recours à des amines et à la ventilation mécanique, invasive ou non invasive, pourra être nécessaire. Les inibiteurs de la phosphodiesterase par voie IV ont une bonne indication dans ce contexte si la pression artérielle est conservée.
Question 3 – Les infarctus du myocarde périopératoires : caractéristiques, moyens de diagnostic
Les infarctus du myocarde périopératoires sont fréquemment asymptomatiques (50 à 70 % des cas) et électriquement peu parlants. En effet, il s’agit fréquemment d’infarctus sous-endocardiques se manifestant par une ischémie sous-endocardique de type sous-décalage du segment ST. Ces infarctus évoluent la plupart du temps vers l’absence d’ondes Q séquellaires, avec parfois un rabotage de l’onde R. Les infarctus du myocarde périopératoires sont généralement révélés par une élévation de la troponine. Leur fréquence est d’environ 5 % en chirurgie vasculaire2. Cependant, il existe certaines populations particulièrement à risque, tels que les patients présentant une fracture du col du fémur. En effet, les séries récentes retrouvent une fréquence d’infarctus du myocarde périopératoire d’environ 20 à 30 % chez ces patients [3,4].
Question 3-a : Quelle est la définition de l’infarctus du myocarde périopératoire ?
L’infarctus du myocarde périopératoire se présente généralement sous deux formes :
Soit une forme rare révélée par un choc cardiogénique, éventuellement des troubles rythmiques ou des troubles de conduction auriculo-ventriculaire, une hypotension artérielle et une akinésie à l’échocardiographie. Il s’agit des infarctus du myocarde de type I, dont la forme est rarement retrouvée dans le contexte périopératoire.
Soit chez un patient asymptomatique, l’infarctus est révélé par une élévation de troponinémie et l’existence d’anomalies électriques ou échographiques. Il s’agit d’un infarctus du myocarde de type II dont la forme est le plus fréquemment retrouvée dans le contexte périopératoire. Les infarctus du myocarde sont décrits grâce à une définition universelle [5]. Les infarctus du myocarde sont définis par la présence d’une nécrose myocardique (mort cellulaire) dans un contexte clinique compatible avec une ischémie myocardique.
Du fait de l’avènement de biomarqueurs sériques plus spécifiques, plus sensibles et de techniques d’imagerie plus précises, on peut détecter des nécroses de plus en plus petites, ce qui a permis de revoir la définition ancienne de l’infarctus du myocarde où on demandait deux critères sur les trois que sont les symptômes, les critères électriques et enzymatiques. Parmi les critères biochimiques, il faut préférer la troponine à cause de sa cardiospécificité. Du fait de la diversité des techniques de dosage et de leur absence de standardisation, les valeurs de troponinémie ne sont pas comparables d’un centre à l’autre.
Question 3-b : Circonstances d’apparition d’un infarctus du myocarde périopératoire [5]
a) Un des cinq critères doit être présent :
1) élévation d’un biomarqueur (troponine) avec présence d’une ischémie marquée par :
— des symptômes cliniques d’ischémie (douleurs, dyspnée …)
— ou des modifications électriques : sus ou sous-décalage du segment ST ou apparition d’un bloc de branche gauche.
— ou l’apparition d’une onde Q sur l’électrocardiogramme
— ou une anomalie segmentaire ou la perte d’une zone viable en échographie ou en scintigraphie.
2) mort subite inattendue avec signe évocateur
3) angioplastie : élévation d’un biomarqueur (multiplié par 3)
4) après chirurgie cardiaque : multiplication par 5 d’un biomarqueur avec une onde Q ou un bloc de branche gauche ou documentation en coronarographie ou perte d’une zone viable en imagerie
5) confirmation par un examen anatomopathologique
Les infarctus du myocarde périopératoires sont souvent révélés dans la 1e circonstance : augmentation de la troponinémie avec, soit des signes électriques évoquant une ischémie, soit des signes cliniques, soit des signes ischémiques (hypo ou akinésie) en échocardiographie.
b) La classification clinique des infarctus retrouve 5 types :
— type I : infarctus du myocarde spontané lié à une ischémie par évènement coronarien, dû à une érosion et/ou une rupture, une fissuration ou une dissection de plaque
— type II : secondaire à une ischémie liée soit une augmentation de la demande en oxygène, soit à une diminution de l’apport en oxygène
— type III : mort subite
— type IV :
- IVa : infarctus du myocarde sur angioplastie
- IVb : infarctus du myocarde sur thrombose de stent
— type V : infarctus du myocarde après pontage coronarien chirurgical
Dans le contexte post-opératoire de la chirurgie non cardiaque, les infarctus du myocarde sont généralement de type II, parfois de type I [6].
Il importe de bien comprendre qu’une élévation de troponine est spécifique du myocarde, mais non spécifique d’un infarctus. En effet, il existe de nombreuses autres raisons de présenter une troponinémie positive [7]. Les étiologies les plus fréquentes en réanimation ou en post-opératoire étant les épisodes de tachycardie, les myocardites, les myocardiopathies hypertrophiques, les chocs hypovolémiques, les chocs septiques, les embolies pulmonaires, les épisodes d’insuffisance cardiaque congestive …
Question 4 – Quelle est la cinétique de la troponine ?
Après le début d’un infarctus du myocarde, la troponine commence à s’élever après la 2e ou 3e heure pour atteindre un pic vers la 20e heure, avec un dosage qui reste positif jusqu’à J7. Ceci implique qu’en cas de troponinémie positive, il importe de faire une cinétique de la troponine pour connaître la valeur du pic et l’évolution du taux [8].
Question 5 – Existe-t-il un seuil de troponine pour affirmer le diagnostic d’infarctus du myocarde ?
On ne peut pas retenir de seuil spécifique. En effet, du fait de l’existence d’un grand nombre de techniques de dosages et de l’hétérogénéité des épitopes reconnus, il n’y a pas de standardisation des méthodes de dosage, ce qui rend les valeurs non comparables. D’autre part, la troponine n’est pas spécifique d’un infarctus du myocarde. Cependant, dans le contexte postopératoire, il semblerait que plus la troponinémie est élevée, plus la probabilité de présenter un infarctus du myocarde est importante [9].
Question 6 – Quelle est la valeur d’une troponinémie positive en post-opératoire ?
Une troponine positive a une valeur diagnostique et une valeur pronostique : Une troponinémie positive peut être symptomatique d’un infarctus du myocarde, ou d’une autre étiologie (cf supra). Quoi qu’il en soit, une troponinémie positive en période post-opératoire a une valeur pronostique, non pas à court terme, mais à long terme. En effet, les courbes de survie réalisées 3 à 5 ans après l’intervention chirurgicale montrent une relation entre mortalité et pic de troponinémie, ceci encourage donc à essayer de comprendre l’étiologie de la troponinémie positive, et à prendre en charge ces patients en post-opératoire.
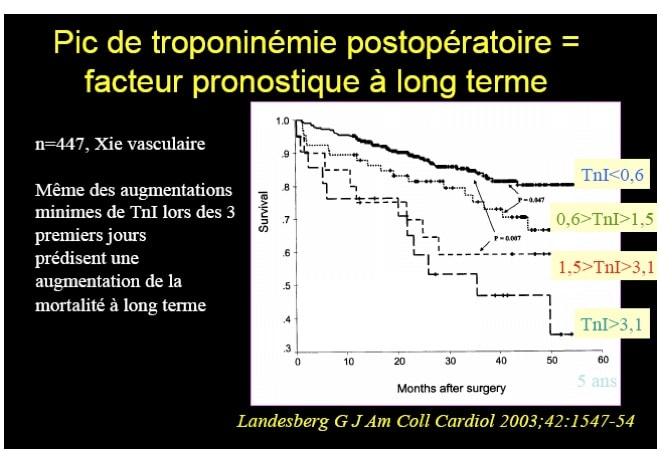
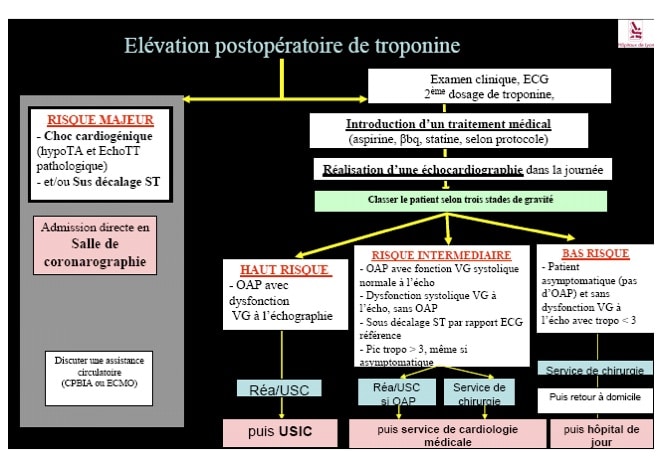
Question 7 – Que faire en cas de troponinémie positive en postopératoire ?
En cas de troponinémie positive en post-opératoire chez un patient surveillé en réanimation, il convient, en tous les cas, de réaliser :
— une cinétique de la troponinémie
— une échocardiographie
— un électrocardiogramme. Le dosage du BNP ou des NT-proBNP pourra aussi, si besoin, aider à stratifier les patients [10].
La prise en charge des patients présentant un infarctus du myocarde périopératoire est identique à celle du patient médical avec quelques spécificités [11].
— Chez les patients ST-, un traitement médical doit être mis en place, associé à une stratification du risque.
— Chez les patients présentant un électrocardiogramme montrant un sus-décalage du segment ST (ST+), la mise en place d’un traitement médical doit être entreprise, et la question de la reperfusion doit être envisagée. Une fibrinolyse est bien entendu contre-indiquée en post-opératoire, et une coronaroventriculographie doit pouvoir être réalisée avec une utilisation prudente des médicaments anti G2b3a12.
On peut proposer le schéma suivant en cas d’élévation post-opératoire de la troponine en fonction de la stratification du risque réalisé.
Question 8 – A qui faut-il réaliser une troponinémie en post-opératoire ? [13]
Une troponinémie doit être systématiquement réalisée en fonction du risque lié au patient et du risque opératoire. On estime qu’un score de Lee > 2 doit impliquer la réalisation d’une troponinémie post-opératoire (score de Lee : risque chirurgical, antécédents d’insuffisance cardiaque, antécédents d’angine de poitrine, antécédents d’insuffisance rénale, antécédents de diabète, antécédents d’accident vasculaire cérébral ou accident ischémique transitoire). D’autre part, une tropinénémie devra aussi être réalisée en cas d’hypotension sévère chez un patient à risque, ou en cas de choc cardiogénique, ou en cas de sus ou sous-décalage du segment ST constatés lors de la période per-opératoire. Ces conditions devraient conduire systématiquement à la surveillance d’un patient à risque en post-opératoire dans un service adapté, soit en surveillance continue, soit en réanimation
Références
1. Badner NH, Knill RL, Brown JE, Novick TV, Gelb AW : Myocardial infarction after noncardiac surgery. Anesthesiology 1998 ; 88 : 572-8
2. Devereaux PJ, Goldman L, Yusuf S, Gilbert K, Leslie K, Guyatt GH : Surveillance and prevention of major perioperative ischemic cardiac events in patients undergoing noncardiac surgery : a review. CMAJ 2005 ; 173 : 779-88
3. Ausset S, Auroy Y, Lambert E, Vest P, Plotton C, Rigal S, Lenoir B, Benhamou D : Cardiac troponin I release after hip surgery correlates with poor long-term cardiac outcome. Eur J Anaesthesiol 2008 ; 25 : 158-64
4. Fisher AA, Southcott EN, Goh SL, Srikusalanukul W, Hickman PE, Davis MW, Potter JM, Budge MM, Smith PN : Elevated serum cardiac troponin I in older patients with hip fracture : incidence and prognostic significance. Arch Orthop Trauma Surg 2008 ; 128 : 1073-9
5. Thygesen K, Alpert JS, White HD : Universal definition of myocardial infarction. J Am Coll Cardiol 2007 ; 50 : 2173-95
6. Siniorakis E, Kirvassilis G, Exadactylos N : Intraoperative myocardial infarction in non-cardiac surgery : is a universal definition feasible ? Eur Heart J 2008 ; 29 : 567
7. Mahajan N, Mehta Y, Rose M, Shani J, Lichstein E : Elevated troponin level is not synonymous with myocardial infarction. Int J Cardiol 2006 ; 111 : 442-9
8. Le Manach Y, Perel A, Coriat P, Godet G, Bertrand M, Riou B : Early and delayed myocardial infarction after abdominal aortic surgery. Anesthesiology 2005 ; 102 : 885-91
9. Howell SJ, Thompson JP, Nimmo AF, Snowden C, Edwards ND, Carlisle J, Suleiman MS, Baumbach A : Relationship between perioperative troponin elevation and other indicators of myocardial injury in vascular surgery patients. Br J Anaesth 2006 ; 96 : 303-9
10. Mahla E, Baumann A, Rehak P, Watzinger N, Vicenzi MN, Maier R, Tiesenhausen K, Metzler H, Toller W : N-terminal pro-brain natriuretic peptide identifies patients at high risk for adverse cardiac outcome after vascular surgery. Anesthesiology 2007 ; 106 : 1088-95
11. Adesanya AO, de Lemos JA, Greilich NB, Whitten CW : Management of perioperative myocardial infarction in noncardiac surgical patients. Chest 2006 ; 130 : 584-96
12. Berger PB, Bellot V, Bell MR, Horlocker TT, Rihal CS, Hallett JW, Dalzell C, Melby SJ, Charnoff NE, Holmes DR, Jr. : An immediate invasive strategy for the treatment of acute myocardial infarction early after noncardiac surgery. Am J Cardiol 2001 ; 87 : 1100-2
13. Fleisher LA, Beckman JA, Brown KA, Calkins H, Chaikof E, Fleischmann KE, Freeman WK, Froehlich JB, Kasper EK, Kersten JR, Riegel B, Robb JF, Smith SC, Jr., Jacobs AK, Adams CD, Anderson JL, Antman EM, Buller CE, Creager MA, Ettinger SM, Faxon DP, Fuster V, Halperin JL, Hiratzka LF, Hunt SA, Lytle BW, Md RN, Ornato JP, Page RL, Riegel B, Tarkington LG, Yancy CW : ACC/AHA 2007 Guidelines on Perioperative Cardiovascular Evaluation and Care for Noncardiac Surgery : Executive Summary : A Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to Revise the 2002 Guidelines on Perioperative Cardiovascular Evaluation for Noncardiac Surgery) : Developed in Collaboration With the American Society of Echocardiography, American Society of Nuclear Cardiology, Heart Rhythm Society, Society of Cardiovascular Anesthesiologists, Society for Cardiovascular Angiography and Interventions, Society for Vascular Medicine and Biology, and Society for Vascular Surgery. Circulation 2007 ; 116 : 1971-96.
Vincent Piriou


